Взаимодействие - белка
Cтраница 1
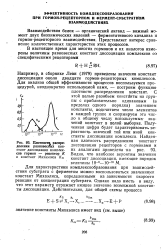 |
Плотности, распределения равновесных констант диссоциация комплексов гормон - рецептор К. [1] |
Взаимодействия белок - органический лиганд - важный момент двух биохимических явлений - ферментативного катализа и гормон-рецепторного взаимодействия. Представляет интерес сравнение количественных характеристик этих процессов. [2]
При исследовании взаимодействий белок - вода первостепенную роль играет форма, в которой представлен белок - раствор, пленка или порошок. Использование твердых образцов позволяет изменять активность воды в широком интервале. По этой причине центральное место в настоящей работе отведено именно таким образцам. Возможно, что конформация молекулы белка может изменяться при высушивании раствора белка до состояния гидратированного твердого тела. Приводимые ниже экспериментальные данные указывают на то, что конформация молекул в сухом состоянии лишь незначительно отличается от конформации в разбавленном водном растворе. [3]
Предыдущее описание взаимодействий белок - растворитель с помощью энергетической карты пространства растворителя вблизи молекулы белка является лишь первым, грубым приближением к полному решению проблемы. Так как форма и главные особенности пространства растворителя вблизи поверхности белка на этих картах ясно обозначены, то легко видеть, что включение в вычисления сильных и строго направленных взаимодействий между молекулами воды приведет к тому, что пространство, занятое растворителем, будет охарактеризовано различным образом, особенно в отношении структуры гидратных оболочек за его пределами. Вследствие того что большая часть растворителя находится в разупо-рядоченном состоянии, необходимо статистическое описание, а именно следует рассмотреть большое число различных конфигураций системы белка и растворителя, каждая из которых дает свой вклад в усредненные свойства системы пропорционально значению больцмановского фактора. [4]
Для оценки величин взаимодействий белок - вода менее трудоемким способом были проведены следующие приближенные вычисления. На основании предположения, что молекула белка обладает уникальной фиксированной структурой, определяемой методами рентгеновской кристаллографии, рассчитываются взаимодействия между белком и единственной молекулой воды в отсутствие других молекул растворителя. После этого для данной простой системы можо рассмотреть поочередно все положения и ориентации единственной молекулы воды относительно белка. Рассчитанные значения энергии, представленные в виде трехмерной карты, весьма информативны в отношении описания пространства, занятого в кристалле растворителем. Принималось, что одна треть объема кристалла заполнена растворителем. [5]
В настоящей статье описано моделирование взаимодействий белок - растворитель в кристалле ИТПЖБ, в результате которых молекулы воды быстро перераспределяются по всему доступному пространству между молекулами белка. Вероятность того, что большое перемещение молекулы окажется энергетически допустимым, повышается не пересчетом этих перемещений к положениям, избранным всецело случайно. Вместо этого просчитываются большие перескоки только в положения, которые энергетически относительно выгодны. Перечень таких положений сохраняется в форме координат набора воображаемых молекул воды, которые занимают изменяющиеся и одновременно энергетически выгодные положения в системе, но которые в свою очередь не влияют на конфигурацию системы. Положения воображаемых молекул воды подбираются с помощью как малых, так и больших перемещений. Локализации реальных молекул воды устанавливаются с помощью как малых, так и больших перемещений и путем обмена по закону случая взаимных положений реальных и воображаемых молекул воды. [6]
Хотя невозможно количественно охарактеризовать степенью ромбичности природу взаимодействия белок - порфирин и структурные изменения, необходимые для искажения электронной структуры катиона железа, сравнение ромбических и тетрагональных составляющих симметрии тема высокоспиновых ферригемопротеинов [161,162] подчеркивает важность контактов между каркасом порфирина и соседними боковыми цепями аминокислот. Данные ЭПР [161, 162] свидетельствуют о том, что структурные изменения, влияющие на порфириновые или аксиальные лиганды, могут передаваться к центральному координированному катиону металла. [7]
Во всех мостиковых комплексах фермент - металл - лиганд ион металла благодаря своим уникальным координационным свойствам играет важную роль во взаимодействии белок - лиганд. Хотя предположение о каталитическом участии ионов металла и весьма привлекательно, однако убедительные доказательства их каталитической роли в биологических системах были получены лишь в нескольких случаях. Итак, роль иона металла в связывании и в катализе в биологических системах не легко разделить, а модельные исследования обладают лишь некоторой степенью приближения. [8]
Существует стремление в конечном счете не только описать структуру воды вблизи поверхности белка, но и объяснить эту структуру в терминах энергий взаимодействия белок - вода и вода - вода. [9]
Изолированные объемы с низкой энергией, достаточно большие, чтобы вместить единственную молекулу воды, на самом деле не будут содержать ее, если энергия взаимодействия белок - вода выше - 15 ккал / моль. В кристалле ИТПЖБ имеется несколько карманов с низким значением энергии. [10]
 |
Схема обратимых реакций тетрамеркых гемоглобинов, которые проявляют кооперативное взаимодействие белковых субъединиц. [11] |
В окислительно-восстановительной реакции зависимость коэффициента Хилла ( меры кооперативности) от рН - изменение н от 1 1 при рН 6 до 2 7 при рН 9 [143] - легко объясняется, однако, на основе спиновых состояний окисленных координационных соединений, вовлекаемых в реакцию [111], и вывода [133-136] о том, что переходы спинового состояния железа сопровождаются изменениями несвязывающих взаимодействий белок - порфирин. [12]
Однако реакции конденсации такого рода, приводящие к образованию химически устойчивых продуктов типа модифицированных белков, существенно отличаются от тех взаимодействий, которые могут иметь место между белками и поверхностноактивными веществами. В результате этих взаимодействий белок может претерпеть следующие изменения. [13]
Лишь один тип белков, иммуноглобулины, имеет максимально возможное число центров присоединения. Поэтому систематический анализ систем иммуноглобулин - лиганд позволяет выяснить общие принципы взаимодействий белок - лиганд. Архитектура иммуноглобулинов может также служить основой для синтеза in vitro полипептидов с желаемыми свойствами. [14]
Общие особенности карты и кристаллографически определяемой структуры воды можно подытожить следующим образом. На расстоянии около 1 А от мест кристаллографической локализации молекул воды распределение низших энергий взаимодействия белок - вода находится примерно посредине интервала от - 15 до - 10 ккал / моль. Локализацию 17 из 47 молекул воды можно четко установить по локальному минимуму энергии. Следующие 13 молекул связаны, прямо или косвенно, по крайней мере с одной из этих 17 молекул предположительно с помощью водородных связей. Поэтому представляется очевидным, что в результате взаимодействия их с молекулами белка и с первой группой молекул воды, находящихся в упорядоченном состоянии, образуется дополнительный набор молекул воды с положениями, отвечающими низким значениям энергии. [15]
Страницы: 1 2