Взаимодействие - окись - кальций
Cтраница 1
Взаимодействие окиси кальция с двуокисью углерода начинается при 350 С и ускоряется при повышении температуры. Значительная скорость достигается при 600 С и выше. Водяные пары ускоряют рекарбонизацию при температуре ниже температуры разложения гидрата окиси кальция и незначительно замедляют ее выше этой температуры. [1]
Реакция взаимодействия окиси кальция с кремнеземом, окислами железа и алюминия завершается тем быстрее, чем тоньше помол сырьевой смеси и лучше она гомогенизирована. Для свойств образовавшегося клинкера большое значение имеет скорость охлаждения. Быстрое охлаждение приводит к тому, что часть расплава не успевает кристаллизоваться и остается в виде так называемого клинкерного стекла, а образовавшиеся минералы фиксируются в своих высокотемпературных формах, отличающихся повышенной химической активностью. [2]
Скорость взаимодействия окиси кальция с водой и соответственно скорость гашения при повышении температуры на каждые 10 С увеличивается в 2 раза. С повышением температуры гашения от 20 до 100 С процесс ускоряется в 28, т.е. в 256 раз. Целесообразно гасить известь при повышенном давлении в специальных барабанах. [3]
Процесс взаимодействия окиси кальция с водой гашением извести, а полученный белый порошо известью-пушонкой. [4]
При взаимодействии окиси кальция с многокомпонентными газовыми смесями, содержащими сероводород, кроме указанных реакций могут протекать реакции взаимодействия отдельных компонентов между собой и с окисью кальция. Для выявления термодинамических характеристик всего сложного процесса, очевидно, необходимо иметь данные по термодинамике отдельно протекающих реакций. С этой целью были проведены расчеты термодинамического равновесия реакции СаО HaS г CaS 4 - Н2О при 600 - 1400 С. [5]
При взаимодействии окиси кальция с водой образуется гидрат окиси кальция. [6]
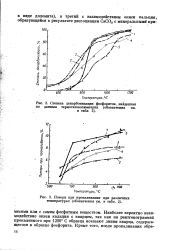 |
Степень декарбонизации фосфоритов, найденная.| Потери при прокаливании при различных температурах ( обозначения в 2. [7] |
Наиболее вероятно взаимодействие окиси кальция с кварцем, так как на рентгенограммах прокаленного при 1200 С образца исчезают линии кварца, содержащегося в образце фосфорита. [8]
В результате взаимодействия окиси кальция с кремнеземом образуется главным образом двухкальциевый силикат с темп. [9]
По окончании реакции взаимодействия окиси кальция с водой полученный продукт сильно разбавить водой, размешать стеклянной палочкой и отфильтровать жидкость. Как называется полученный чистый раствор. [10]
Последний образуется при взаимодействии окиси кальция с водой после затворения высокообжигового гипса. [11]
Образование щелочи при взаимодействии окиси кальция с водой производят следующим образом: окись кальция, взятую в виде кусков, обливают небольшим количеством воды. Впитывая воду, куски рассыпаются в порошок. После взбалтывания смеси этого порошка с водой смесь испытывают раствором красного лакмуса. Посинение последнего показывает, что раствор является щелочью. [12]
Как называется в технике реакция взаимодействия окиси кальция с водой. [13]
Твердое кристаллическое вещество; получают в электрических печах при взаимодействии окиси кальция с углеродом при высоких температурах. Применяется для получения ацетилена и для производства цианамида кальция. [14]
Гидроокись кальция Са ( ОН) 2 ( гашеная известь) является продуктом взаимодействия окиси кальция с водой. [15]
Страницы: 1 2 3