Межмолекулярное взаимодействие
Cтраница 1
Межмолекулярные взаимодействия обусловливают формирование четвертичной структуры, которая проявляется в образовании молекул ферментов, нуклеопротеидов, липопротеидов, гликолипидов, а также мицелл, фибрилл и других макроструктур. [1]
Межмолекулярное взаимодействие и получение нерастворимых полимеров происходят главным образом при нагревании полиакрилонитрила в твердом состоянии. В растворе диметйлформамида образуются менее структурированные полимеры, по-видимому, состоящие из более протяженных блоков сопряжения. [2]
Межмолекулярное взаимодействие в полимерах существенно влияет не только на прочность при кратковременных испытаниях ( см. гл. [3]
Межмолекулярные взаимодействия склонных к структурированию ВМС приводят к образованию пространственных надмолекулярных структур, состоящих из множества макромолекул. В зависимости от характера связей надмолекулярные структуры делят на физические ассоциаты, в которых действуют силы Ван-дер - Ва-альса, и на физико-химические комплексы с более прочными химическими связями. [4]
Межмолекулярные взаимодействия в таких жидкостях чаще всего имеют характер слабых ван-дер-ваальсовых, что не исключает развития молекулярной ассоциации. Типичны в этом отношении нефтяные масла и индивидуальные масляные углеводороды, обладающие аномально высокой зависимостью вязкости от температуры. [5]
Межмолекулярные взаимодействия трех упомянутых выше типов - диполь-диполь, диполь - индуцированный диполь и индуцированный диполь - индуцированный диполь обеспечивают сравнительно невысокие энергии притяжения. Значительно более прочны водородные связи. Их энергии находятся в пределах 5 - 10 ккал / моль. [6]
Межмолекулярное взаимодействие осуществляется благодаря действию между молекулами, независимо от того, являются они полярными или нет, сил Ван-дер - Ваальса. Эти силы названы так потому, что впервые межмолекулярное взаимодействие стал учитывать голландский физик Ван-дер - Ваальс ( 1873 г.) при объяснении свойств реальных газов и жидкостей. [7]
Межмолекулярное взаимодействие проявляется во многих эффектах, в том числе и в поверхностном натяжении жидкости. В объеме жидкости межмолекулярные силы, действующие на данную молекулу, в значительной мере взаимно компенсированы. В поверхностном слое жидкости эти силы некомпенсированы и поверхность жидкости обладает свободной энергией. Поскольку межмолекулярное взаимодействие связано со структурой молекулы, с ним связана и величина о. Измерения этой величины могут дать сведения о молекулярной структуре. [8]
Межмолекулярные взаимодействия играют непренебрежимо малую роль в определении оптимальной структуры изотактических виниловых полимеров. Именно они диктуют тип спирали поли-ж - и поли-о-фторстирола. Нередки случаи, когда две или три полиморфные модификации кристаллического, полимера имеют разные параметры спиралей. Например, поливинил-циклогексан ( цикло - СбН) [139] имеет в зависимости от температуры и условий синтеза две кристаллические формы. [9]
Межмолекулярное взаимодействие отличается от химического тем, что оно проявляется на значительно больших расстояниях и характеризуется отсутствием насыщаемости и специфичности, небольшими энергиями. [10]
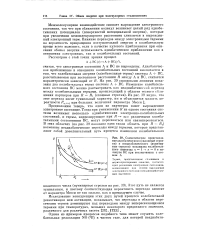 |
Схематическое представление адиабатического ( сплошные стрелки и неадиабатического ( пунктирные стрелки механизма колебательного перехода га 1-гс 0в молекуле ВС при столкновении с атомом А. [11] |
Межмолекулярное взаимодействие снимает вырождение электронного состояния, так что при сближении молекул возникает целый ряд адиабатических потенциалов ( поверхностей потенциальной энергии), которые при увеличении межмолекулярного расстояния сливаются в вырожденный электронный терм. [12]
Межмолекулярные взаимодействия, обсуждавшиеся в предыдущем разделе, чувствительны к температуре, что приводит к температурной зависимости химических сдвигов. Температура может влиять на сдвиги и другим путем. Например, при охлаждении может подавляться вращение вокруг некоторых связей, которое возможно при более высоких температурах. [13]
Межмолекулярное взаимодействие таких радикалов должно приводить к образованию поперечных связей, не сопровождаясь исчезновением виниленовых групп. Непосредственное участие виниленовых групп в образовании сшивок кажется необычным, если учесть независимость величины Gnc от концентрации виниленовых групп. [14]
Межмолекулярное взаимодействие может быть различным в зависимости от природы компонентов раствора. В сплавах металлов - это силы, обусловливающие металлическую связь, в солевых расплавах основную роль играет электростатическое взаимодействие ионов, в водных и неводных растворах электролитов имеет место сочетание действия зарядов ионов и так называемых ван-дер-ваальсовых сил. В растворах диэлектриков, например углеводородов, ван-дер-ваальсово взаимодействие превалирует над всеми другими видами межмолекулярных сил. [15]
Страницы: 1 2 3 4