Слабое межмолекулярное взаимодействие
Cтраница 3
Состав равновесной смеси мы определили, предполагая, что благодаря слабым межмолекулярным взаимодействиям распределение конформеров для алкана в газовой и жидкой фазах идентично. [31]
Весь комплекс свойств полимеров определяется наличием линейных цепных молекул с относительно слабым межмолекулярным взаимодействием. [32]
На рис. 17.2 указаны типы физико-химических явлений, в которых существенно проявляются слабые межмолекулярные взаимодействия. Вряд ли стоит пытаться оценить степень важности этих взаимодействий в тех или иных случаях. Полное теоретическое рассмотрение проблем, схематически изображенных на рис. 17.2, включает не только вычисление энтальпийного члена ( напомним, что энергия взаимодействия, определяемая из теоретических или эмпирических выражений, представляет собой внутреннюю энергию), но и вычисление методами статистической термодинамики энтропийного члена. Остается добавить, что существует постепенный переход между взаимодействиями, приводящими к образованию химической связи, и слабыми межмолекулярными взаимодействиями; доказательством такой точки зрения является существование водородной связи. Можно полагать, что в этом случае важную роль играет вклад дисперсионных сил. [33]
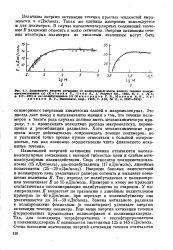 |
Зависимость энергии активации от молекулярной массы вязкого течения полнди. [34] |
Наименьшей энергией активации течения отличаются высокомолекулярные соединения с высокой гибкостью цепи и слабым межмолекулярным взаимодействием. Так, переход от полибутадиенов к полиизопре-нам увеличивает Е до 55 кДж / моль. Примерно к этому же приводит статистическая сополимеризация полибутадиена со стиролом. У полипропилена Е возрастает по сравнению с линейным полиэтиленом примерно до 46 кДж / моль, при переходе к полиизобутилену она увеличивается до 54 - 59 кДж / моль. Замена метильного радикала в полипропилене фенильным ( в полистироле) удваивает энергию активации течения полимера. [35]
Здесь для иллюстрации этого перехода избран наиболее простой случай: газ со слабым межмолекулярным взаимодействием. На первый взгляд совсем не очевидно, что полученное там уравнение Ландау может иметь какое-либо отношение к общему кинетическому уравнению, выведенному в гл. Однако ниже будет показано, что если записать общее уравнение в явном виде с помощью развитого в гл. [36]
Отклонение в случае гелия от наблюдаемой общей закономерности, вероятно, обусловлено чрезвычайно слабым межмолекулярным взаимодействием. [37]
И - разумеется - все будет наоборот при высоких / о и слабых межмолекулярных взаимодействиях. [38]
Возник вопрос: если подобный перенос энергии по триплетным уровням возможен в условиях слабого межмолекулярного взаимодействия, вызванного наложением периферических частей электронных оболочек двух молекул, то этот процесс может, в принципе, еще лучше осуществиться между двумя группами той же молекулы. Трудность заключается в том, что весьма сложно найти автономные группы в сопряженных ароматических молекулах и приписать им раздельные системы электронных уровней. Тем не менее со всеми оговорками мы рассмотрели экспериментально возможность подобного внутримолекулярного переноса между различными группами той же молекулы. [39]
Газовая хроматография подчиняется законам - физической адсорбции и абсорбции, происходящей под действием сравнительно слабых межмолекулярных взаимодействий. В хроматографической колонке вещества сорбируются, определенное время находятся в сорбированном состоянии, а потом десорбируются потоком газа-носителя. Межмолекулярные силы притяжения - силы Ван-дер - Ваальса имеют электростатическую природу. [40]
 |
Схематическое изображение структуры исходного ( а и сшитого ( б каучука. [41] |
В соответствии с этой теорией вулканизат рассматривается как совокупность гибких линейных цепей со слабым межмолекулярным взаимодействием, соединенных редкими химическими связями [ 1, с. [42]
 |
Некоторые свойства связей СН3 - Х. [43] |
Важно отметить, что фторпроизводные не подчиняются указанным закономерностям, вероятнее всего, из-за весьма слабых межмолекулярных взаимодействий в этих соединениях. [44]
Малая растворимость азота в воде, а также его очень низкая температура кипения объясняются весьма слабыми межмолекулярными взаимодействиями как между молекулами азота и воды, так и между молекулами азота. [45]
Страницы: 1 2 3 4