Ориентационное индукционное взаимодействие
Cтраница 2
В случае неполярных молекул, например Н2, N2, или атомов благородных газов ориентационное и индукционное взаимодействия отсутствуют. Однако известно, что водород, азот и благородные газы сжижаются. Для объяснения этих фактов Лондон ввел понятие дисперсионных сил межмолекулярного взаимодействия. [16]
 |
Схемы сил межмолекулярного взаимодействия. а-ориентационные. б-индукционные. е-дисперсионные. [17] |
В случае неполярных молекул, например, Нг, N2, или атомов благородных газов, ориентационное и индукционное взаимодействие отсутствует. Однако известно, что водород, азот и благородные газы сжижаются. Для объяснения этих фактов Лондон ввел понятие дисперсионных сил межмолекулярного взаимодействия. Эти силы действуют между любыми атомами и молекулами независимо от их строения. В каждый данный момент времени направление диполей может быть иным. Однако их согласованное возникновение обеспечивает слабые силы взаимодействия, приводящие к образованию жидких и твердых тел. [18]
Способность веществ ( алюмосиликатов, активированного угля и др.) адсорбировать на своей поверхности некоторые компоненты из нефтепродуктов обусловливается дисперсионным, ориентационным и индукционным взаимодействием углеводородов и широко используется в технологии производства масел, парафинов и других продуктов. [19]
Этими двумя слагаемыми межмолекулярное притяжение не исчерпывается. Ориентационные и индукционные взаимодействия составляют лишь часть наблюдаемого ван-дер-ваальсовского притяжения, причем для многих соединений - меньшую часть его. Для таких же веществ, как Ne и Аг, оба слагаемых равны нулю ( частицы этих веществ неполярны, и их электронные оболочки являются весьма жесткими); тем не менее благородные газы сжижаются. Это свидетельствует о существовании еще одной составляющей межмолекулярных сил. [20]
Этими двумя слагаемыми межмолекулярное притяжение не исчерпывается. Ориентационные и индукционные взаимодействия составляют лишь часть ван-дер-ваальсовского притяжения, причем для многих соединений - меньшую часть его. Для таких же веществ, как 1 Ne и Аг, оба слагаемых равны нулю ( частицы этих веществ неполярны, и их электронные оболочки являются весьма жесткими); тем не менее благородные газы сжижаются. Это свидетельствует о существовании еще одной составляющей межмолекулярных сил. [21]
Атомы в основном состоянии имеют сферически симметричное распределение электрического заряда и поэтому вообще не обладают постоянными мультипольными моментами. Следовательно, ориентационное и индукционное взаимодействия здесь не возникают. Вместе с тем взаимодействие между инертными атомами оказывается не менее существенно, чем между полярными молекулами или молекулами, имеющими квадрупольные моменты. Это ясно, например, уже из самого существования жидкостей и кристаллов из инертных атомов. Как известно, лишь гелий вследствие квантовых эффектов не кристаллизуется при нормальных условиях. [22]
Процесс основан на избирательном выделении полярных поверхностно-активных компонентов сырья - смолистых веществ, кислород - и серусодержащих соединений, полициклических ароматических углеводородов на развитой пористой поверхности адсорбента. Высокая адсорбируе-мость полярных компонентов сырья на активном высокопористом адсорбенте обусловлена ориентационным и индукционным взаимодействием активных центров, находящихся на поверхности адсорбента, с полярными и поляризуемыми компонентами сырья. [23]
Водородная связь образуется путем электростатического и донорно-акцепторно-го взаимодействия. Энергия водородной связи включает три составляющие: электростатическую энергию притяжения, преобладающую на больших расстояниях, энергию поляризации ( ориентационное и индукционное взаимодействие) и переноса заряда, проявляющуюся при уменьшении расстояния и способствующую притяжению молекул, и энергию отталкивания. Силы притяжения и отталкивания в водородном мостике сбалансированы. Появление водородной связи понижает суммарную энергию системы. [24]
Электрическая теория адсорбции была развита в работах Лангмюра, Б. В. Ильина, В. В. Тарасова, В. К - Семенченко и др. Как показали работы М. М. Дубинина с сотрудниками, при физической адсорбции на поверхности ионных кристаллов основную роль играют ориентационное и индукционное взаимодействия, а при адсорбции на угле и других подобных материалах определяет процесс дисперсионное взаимодействие. [25]
Силы притяжения между молекулами, которые называют ван-дер-ваальсовыми, обусловливаются тремя видами межмолекулярного взаимодействия: 1) ортнтационное - проявляется между полярными молекулами, стремящимися занять такое положение, при котором их диполи были бы обращены друг к другу разноименными полюсами, а векторы моментов этих диполей были бы ориентированы по одной прямой; 2) индукционное - возникает между индуцированными диполями, причиной образования которых является взаимная поляризация атомов двух сближающихся молекул; 3) дисперсионное - возникает в результате взаимодействия микродиполей, образующихся за счет мгновенных смещений положительных и отрицательных зарядов в молекулах при движении электронов и колебании ядер. Дисперсионные силы действуют между любыми частицами. Ориентационное и индукционное взаимодействие для частиц многих веществ, например Не, Ar, H2, N2, CH4, не осуществляются. Полная энергия ван-дер-ваальсо-вых сил притяжения характеризуется невысокими значениями. С ростом относительных молекулярных масс силы межмолекулярного взаимодействия становятся больше, поэтому повышаются значения таких постоянных, как температуры плавления и кипения. [26]
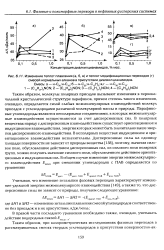 |
Изменение теплот плавления ( а, б, в и теплот модификационных переходов ( г смесей нормальных алканов в присутствии диалкилцианамидов. [27] |
Таким образом, молекулы полярных присадок вызывают изменения в первоначальной кристаллической структуре парафинов, причем степень такого изменения, очевидно, определяется силой слабых межмолекулярных взаимодействий молекул присадок с углеводородами различной молекулярной массы и природы. Парафиновые углеводороды являются неполярными соединениями, в которых межмолекулярные взаимодействия осуществляются за счет дисперсионных сил. В полярных веществах наряду с дисперсионным взаимодействием существует ориентационное и индукционное взаимодействия, энергия которых может быть значительно выше энергии дисперсионного взаимодействия. В неполярных веществах индукционное и ориентационное взаимодействия незначительны. Дисперсионные силы на единицу площади поверхности не зависят от природы вещества [158], поэтому, вычитая силовое поле, обусловленное действием дисперсионных сил, из силового поля полярных групп, можно получить значение силового поля, обусловленного действием ориента-ционных и индукционных сил. [28]
Представление об ориентационном и индукционном взаимодействии позволило понять причины взаимного притяжения молекул в том случае, если все молекулы или часть их являются полярными. Но опыт показывает, что силы Ван-дер - Ваальса действуют между частицами и в тех случаях, когда они неиолярны. Таковы, например, атомы инертных газов, электронные оболочки которых обладают сферической симметрией. С другой стороны, выяснилось, что даже в случае полярных молекул ориентационное и индукционное взаимодействие составляют лишь часть наблюдаемого на опыте ван-дер-ваальсова взаимодействия. [29]
Представление об ориснтационном и индукционном взаимодействии позволило понять причины взаимного притяжения молекул в том случае, если все молекулы или часть их являются полярными. Но опыт показывает, что силы Ван-дер - Ваальса действуют между частицами и в тех случаях, когда они неполярны. Таковы, например, атомы инертных газов, электронные оболочки которых обладают сферической симметрией. С другой стороны, выяснилось, что даже в случае полярных молекул ориентационное и индукционное взаимодействие составляют лишь часть наблюдаемого на опыте ван-дер-ваальсова взаимодействия. [30]
Страницы: 1 2 3