Межионное взаимодействие
Cтраница 2
В крепких растворах межионное взаимодействие сильно осложняется ( гл. [16]
Непосредственной мерой силы межионных взаимодействий могли бы быть константы равновесия образования ионных пар в водном растворе, однако для одновалентных ионов такие пары чрезвычайно неустойчивы. Даже если один из ионов является двухвалентным, константа ассоциации остается незначительной, однако, если оба иона двухвалентны, наблюдаются большие значения констант. [17]
Коэффициент Л, характеризующий межионные взаимодействия, может быть рассчитан по уравнению, полученному Фалькенга-геном на основании теории Дебая-Хюккеля [77], и всегда положителен. [18]
Образование ассоциированных соединений, межионное взаимодействие и взаимодействие ионов с молекулами растворителя, которые имеют место в растворах электролитов, не только заметно сказываются на явлении электропроводности, но значительно осложняют и протекание диффузионных процессов. [19]
В то же время межионное взаимодействие не связано с различиями ионов, а зависит от их общей концентрации в растворе. Это означает, что в разных смесях коэффициент активности одного и того же иона при одинаковой его концентрации будет иметь разное значение. [20]
В очень разбавленных растворах межионные взаимодействия практически отсутствуют. Для сильных электролитов с увеличением концентрации увеличивается число ионов в единице объема и сначала наблюдается увеличение к. Однако при дальнейшем увеличении концентрации раствора взаимодействие между ионами приводит к снижению скорости движения ионов, вследствие чего рост электропроводности замедляется. Наконец, взаимодействие между ионами с ростом концентрации начинает увеличиваться настолько сильно, что это приводит к уменьшению удельной электропроводности. В случае слабых электролитов скорость движения ионов почти не зависит от концентрации, однако по мере увеличения концентрации уменьшается степень диссоциации. Поэтому удельная электропроводность слабых электролитов при одинаковой концентрации значительно меньше, чем в случае сильных электролитов. [21]
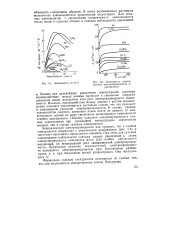 |
Зависимость Kf ( c.| Зависимость эквивалентной электропроводности от разбавления. [22] |
В очень разбавленных растворах межионные взаимодействия практически отсутствуют. [23]
 |
Масса ионов и их скорость движения в воде при 25 С. [24] |
В то же время межионное взаимодействие, замедляющее движение ионов, при бесконечном разведении отсутствует. [25]
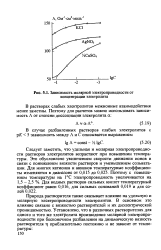 |
Зависимость молярной электропроводности от концентрации электролита. [26] |
В растворах слабых электролитов межионные взаимодействия менее заметны. [27]
Де / z учитывает только электростатические межионные взаимодействия. [28]
О важности учета специфики межионных взаимодействий в уравнениях электрохимической кинетики свидетельствует зависимость скорости электровосстановления анионов Fe ( CN) jj - ( см. рис. V.4), Hg ( CN) f [293], Р1ХГ, PtX - ( XC1 -, Br) [294], Cr ( NCS) [295], CrOJ - [296], PtF - [292], S4O2fl -, S5O - [297, 298], S. [29]
С увеличением ионной силы растворов межионное взаимодействие все сильнее тормозит движение ионов. [30]
Страницы: 1 2 3 4