Гомогенное взаимодействие
Cтраница 1
Гомогенное взаимодействие окиси углерода с водяным паром при температурах ниже 1000 С протекает очень медленно. Для увеличения скорости реакции в промышленности применяют катализаторы на основе окиси железа, кобальта, никеля, меди и других металлов. [1]
Скорость гомогенного взаимодействия двуокиси серы с кислородом настолько мала, что ее до сих пор не удалось измерить. Поэтому можно предположить, что энергия активации гомогенной реакции весьма велика. Основной причиной высокого значения энергии активации является необходимость затраты энергии на разрыв связи в молекуле кислорода для присоединения одного из атомов его к молекуле двуокиси серы. [2]
Для исследования гомогенных взаимодействий обычный химический анализ уже неприменим. Если же взаимодействие различных металлов даже и гетерогенно, то использование обычного химического анализа для его исследования осложняется практической неотделимостью образующихся фаз друг от друга. Затрудняет также исследование металлических систем их непрозрачность. Поэтому для исследования природы продуктов взаимодействия различных металлов должны применяться особые методы, не связанные с необходимостью разделения фаз. [3]
Рассмотрим, например, процесс получения полиэфира при гомогенном взаимодействии органической двухосновной кислоты со спиртом, имеющим две функциональные группы. [4]
Происходит либо гетерогенная рекомбинация этих центров на поверхности частицы, либо гомогенное взаимодействие газообразных продуктов возгонки порошков с активными центрами. [5]
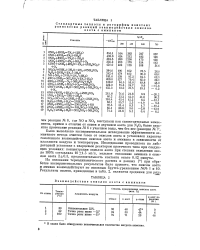 |
Взаимодействие окислов азота с аммиаком. [6] |
Было выполнено экспериментальное исследование эффективности аммиачного метода очистки газов от окислов азота и установлен характер гомогенного взаимодействия окислов азота и аммиака в зависимости от влажности воздуха и температуры. Исследование проводилось на лабораторной установке с кварцевым реактором проточного типа при следующих условиях: концентрация окислов азота при степени окисления около 100 % составляла 10 1.5 мг / л, мольное отношение аммиака к окислам азота 2 0.3, продолжительность контакта около 0.12 минуты. [7]
Поэтому промышленность интересуют такие процессы, в которых перекись водорода образуется по реакциям, протекающим примерно при атмосферном давлении, по-видимому за счет гомогенных взаимодействий, и ее можно отделить при охлаждении до комнатной температуры. При этом желательно применение газовых смесей, содержащих менее 8 - 10 мол. Хотя при давлении 1 am выход перекиси водорода возрастает при охлаждении до температуры ниже атмосферной [ 43J, как и при термической реакции водорода с кислородом, этого недостаточно для компенсации стоимости процесса в связи с применением низкотемпературного охлаждения. [8]
Теоретически увеличение скорости переноса изучали Арис и Келлер [3], Бейли и Ласе [ 81, Бейли и Шарма [63], для которых интерес представляло образование носителей на двух поверхностях пленки при протекании реакций, катализируемых ферментами, и Фридлендер и Келлер [40] и Смит, Мелдон и Колтон [93], которые рассматривали гомогенные взаимодействия в пленке. В последнем случае степень приближения параметра 0 к его равновесному значению очень сильно зависит от толщины пленки. Несмотря на то, что пленка имеет большую толщину поток, тем не менее, может быть невелик. При наличии, однако, тонкой пленки лишь в центре ее могут достигаться равновесные концентрации, причем скорость прямой и обратной реакции оказывает преимущественное влияние на область, находящуюся вблизи двух поверхностей. [9]
Скорость гомогенного взаимодействия S02 с кислородом настолько мала, что ее до сих пор не удалось измерить. Этой энергии недостаточно для образования лишнего атома кислорода, необходимого для разветвления реакционной цепи. Промышленного значения перечисленные способы не имеют. [10]
 |
Основные сведения об огнетушащих порошках. [11] |
Механизм огнетушащего действия порошков заключается в ингибировании горения в результате связывания активных центров цепных реакций, протекающих в пламени. Происходит либо гетерогенная рекомбинация этих центров на поверхности порошков, либо гомогенное взаимодействие газообразных продуктов возгонки порошков с активными центрами. [12]
 |
Равновесие между газообразными NO2 и NjO4, находящимися при давлении 100 к Па и температуре 30 С ( по осям отложены отношения мольных концентраций газов. [13] |
Наиболее надежно для N3O4 устанавливаемое по результатам любых экспериментов произведение физических констант Я ( Dk) 1, которое является основным членом уравнения (8.27) и которое, следовательно, определяет скорость абсорбции, приходящуюся на единицу поверхности и на единицу действующего на нее парциального давления. Большие значения Я ( Dk) l / 2 при повышенных парциальных давлениях могут быть следствием гомогенного взаимодействия с образованием HNO3 и последующей ее абсорбции жидкостью. Такая картина может наблюдаться как при наличии, так и в отсутствие тумана из капелек азотной кислоты. [14]
Понимая несовершенство исходной модели (5.31), мы, тем не менее, видим в ней и существенные достоинства: уже в настоящее время она реально может быть обеспечена необходимой параметрической базой. Важно также, что на рассмотренные здесь представления не накладывается принципиальных ограничений для их развития по линии более сложных гомогенных взаимодействий, например, в системе потенциалзадающих элементов, когда взаимодействия протекают с переносом электронов. [15]
Страницы: 1 2