Диоксетан
Cтраница 1
 |
Согласованное неадиабатическое запрещенное по спину расщепление. [1] |
Активированный диоксетан имеет достаточно энергии, чтобы дать и триплетные, и синглетные и и - состояния, но недостаточно, чтобы дать гс тс - состояния. [2]
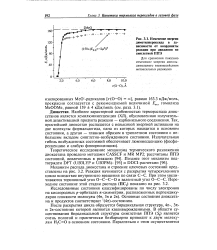 |
Изменение энергии диметилпероксида в зависимости от координаты реакции при движении по синглетной ППЭ. [3] |
Механизм распада диоксетана и строение ключевых состояний представлены на рис. 3.2. Реакция начинается с раскрытия четырехчленного цикла вследствие внутреннего вращения по связи С-С. При этом увеличиваются торсионный угол О-С - С-О и валентный угол О-С - С. [4]
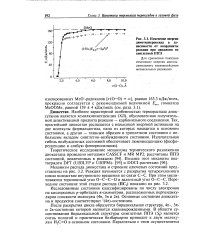 |
Изменение энергии диметилпероксида в зависимости от координаты реакции при движении по синглетной ППЭ. [5] |
Основные состояния диоксетана и продуктов соответствуют ( 4л) - состоянию. [6]
 |
Механизм фотохимической реакции превращения диоксетана в формальдегид. [7] |
Экспериментально обнаружено, что реакция превращения диоксетана в формальдегид приводит к возникновению хемифос-форесценции. Построение поверхностей потенциальной энергии данной реакции в основном и возбужденных синглетном и трип-летном состояниях позволяет объяснить природу этого эффекта. На рис. 124 приведены кривые потенциальной энергии реакции. Кривая потенциальной энергии реакции основного состояния пересекается с соответствующей кривой триплетного возбужденного состояния. Вследствие этого реакция может идти двумя независимыми каналами; адиабатическим с образованием двух молекул формальдегида в основном состоянии и неадиабатическим с возникновением одной молекулы формальдегида в возбужденном триплетном состоянии. Сильная интеркомбинационная конверсия вследствие большого спин-орбитального взаимодействия приводит к тому, что реакция идет почти полностью по неадиабатическому каналу. Этим объясняется большой выход молекул формальдегида в триплетном состоянии с последующим высвечиванием путем фосфоресценции. [8]
Первый из них - вырожденность энергии в переходном состоянии для пиролиза диоксетана. Это показано на рис. 20, в котором все внимание сфокусировано на четырех электронах двух разрываемых связей. Вращение электрона у одного атома кислорода дает и триплетный спин, и п тс - состояние. Изменение в орбитальном угловом моменте приводит к необходимому изменению спина. [9]
 |
Относительные энтальпия и энтропия стационарных точек на ППЭ термоизомеризации диформилпероксида ( 353 К. [10] |
Результаты расчетов разумно согласуются с экспериментальными данными и свидетельствуют, что лимитирующей стадией процесса термораспада диоксетана является гомолиз О-О - связи. Низкая энергия активации распада бирадикала ОСН2СН20 ( - 27.2 кДж / моль по данным CASSCF-расчетов [96]) свидетельствует о малом времени жизни частицы и объясняет неудачную попытку авторов работы [98] зафиксировать триплетный радикальный интермедиат с помощью ловушки. [11]
На основе проведенных расчетов указанный бирадикал - ОССО - был предложен в качестве наиболее вероятного интермедиата в реакции разложения диоксетана, а бирадикал - ССОО - в качестве интермедиата в реакции циклоприсоединения кислорода к этилену. [12]
Биолюминесценцию морских организмов, холодное свечение светлячков и других организмов связывают с промежуточным образованием а-пероксилактонов, распад которых, как и других диоксетанов, сопровождается хемилюминесценцией. [13]
Взглянув на обратную реакцию, мы предсказываем, что возбужденное состояние ( Ь2) - ( i) должно быть необходимым для фотохимической конденсации ацетона в диоксетан. [14]
Исходя из принципа микроскопической обратимости, мы видим, что неправильное, как по спину, так и по симметрии, состояние является, по-видимому, предшественником диоксетана, образующегося фотохимическим путем из ацетона. [15]
Страницы: 1 2