Сравнение - изотерма - адсорбция
Cтраница 1
 |
Схема измерительной установки. [1] |
Сравнение изотерм адсорбции, представленных на рис. 2, а, указывает на заметное различие сорб-ционной емкости молекулярного сита 4А по отношению к применяемым газам. Можно сказать, что адсорбция азота на этом сорбенте более чем в два раза превышает адсорбцию кислорода или аргона, для которых изотермы адсорбции очень близки при комнатной температуре. Большая по сравнению, например, с аргоном адсорбция азота может являться результатом отличия структуры его молекулы, может быть связана с большим квадру-польным моментом азота и энергетически неоднородной поверхностью адсорбента. Подтверждением вышесказанного являются изостерические теплоты адсорбции. [2]
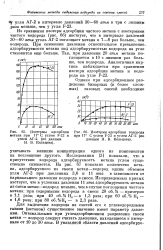 |
Изотермы адсорбции водорода. [3] |
Из сравнения изотерм адсорбции чистого метана с изотермами чистого водорода ( рис. 66) явствует, что в интервале давлений 30 - 60 атм уголь АГ-2 поглощает метана в 7 - 8 раз больше, чем водорода. При снижении давления относительное превышение адсорбируемости метана над адсорбируемостью водорода на угле становится еще больше. Так, при давлении 20 атм метана поглощается в 10 с лишним раз больше, чем водорода. [4]
При сравнении изотермы адсорбции углекислого газа и кривой потенциальной энергии этого процесса наблюдается совершенно иная картина. Эта часть кривой потенциальной энергии не укладывается в уравнение БЭТ, и, таким образом, применение уравнения ( 24) для предсказания величины емкости монослоев, а следовательно, величин поверхности ограничивается лишь теми системами адсорбат - адсорбент, в которых не происходит капиллярной конденсации при низких относительных давлениях. Если для данного адсорбента может быть найден соответствующий адсорбат, уравнение потенциальной энергии имеет то преимущество, что точка, соответствующая заполнению поверхности монослоем, значительно более резко выражена, поскольку последующий процесс адсорбции характеризуется резким, возрастанием кривой. [5]
Далее, сравнение изотерм адсорбции Н2 на катали заторах Pt / Na У, полученных ионным обменом и пропит кой ( рис. 2, 2 - 5), показывает, что дополнительная ад сорбция меньше в случае пропиточных катализаторе: по сравнению с ионообменными. [6]
Помимо теоретического обоснования того или иного вида сравнения изотермы адсорбции, по-видимому, определяющее значение должны иметь критерии экспериментального характера. [7]
Оценка стереоспецифичности адсорбции на сформованных силикагелях может быть проведена из сравнения изотерм адсорбции () - и ( -) - бутанола-2. Хотя изложенный выше метод оценки стереоспецифичности действия адсорбентов дает удовлетворительные результаты в препаративном отношении, он не достаточно точен, поэтому желательно получать количественные данные по адсорбции оптических изомеров сравнительно простой молекулы, например о утанола-2 на различных специфически сформованных силикагелях. [8]
Метод определения инкрементов уменьшения молярной стандартной энергии Гиббса при адсорбции из раствора сводится к сравнению изотерм адсорбции двух, веществ, структура молекул которых отличается только одной деталью структуры, функциональной группой или заместителем. [9]
Метод определения инкрементов уменьшения молярной стандартной энергии Гиббса при адсорбции из раствора сводится к сравнению изотерм адсорбции двух веществ, структура молекул которых отличается только одной деталью структуры, функциональной группой или заместителем. ДО дает значение инкремента уменьшения молярной стандартной энергии Гиббса, обусловленного введением в структуру молекулы этого элемента структуры. [10]
Удельная поверхность таких адсорбентов может быть определена как по методу БЭТ ( 5вэт) так и по одному из способов приведения изотерм адсорбции, например, - методу де Бура [8], о-методу Синга [9] и др. Способ приведения - это сравнение изотермы адсорбции на адсорбенте с неизвестной удельной поверхностью s со стандартной кривой, выражающей в принятой форме изотерму адсорбции для непористого адсорбента одинаковой химической природы и с известной удельной поверхностью. Стандартные кривые обычно нормируются по методу БЭТ. [11]
В работе [132] в качестве объекта кислотной обработки был использован кислый гель, именуемый тонкодисперсным. Сравнение изотерм адсорбции, приведенных на рис. 9 и данных табл. 7, показывает, что повышение концентрации раствора соляной кислоты приводит к возрастанию объема и радиуса пор силикагеля, оставляя практически неизменной величину удельной поверхности. Это означает, что в соответствии с теорией корпускулярного строения силикагеля действие кислоты вызвало уменьшение плотности упаковки частиц, оставив неизменными их размеры. [13]
Сравнение изотерм адсорбции показывает, что с увеличением температуры происходит резкое изменение в поглощении паров воды, в то время как адсорбция бензола практически не изменяется. Если непрокаленный образец поглощает пары воды в значительно больших количествах, нежели бензол, и проявляет гидрофильные свойства, то прокаленный образец обнаруживает гидрофобные свойства, несвойственные для обычных силикагелей, являющихся классическими гидрофильными сорбентами и осушителями. [14]
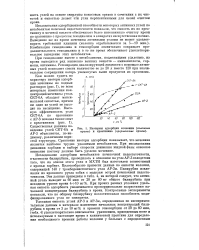 |
Изотермы адсорбции мочевины ( сплошные кривые и креатинина ( прерывистые кривые. [15] |
Страницы: 1 2