Сравнение - потенциал
Cтраница 4
Разница в энергиях гидратации между окисленной и восстановленной формами при переходе, например, от системы [ Ru ( NH3) e ] 3 / 2 к системе [ Ru ( NH3) 5Cl ] 2 / может быть значительной. В таких случаях при сравнении ОВ потенциалов роль характера лигандов проявляется не столь очевидно. [46]
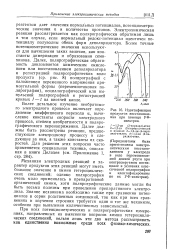 |
Идентификация продуктов восстановления при помощи УФ-спектров. [47] |
Механизм электродных реакций и ха - контролируемом потен-рактер продуктов этих реакций могут иметь циале в условиях клас-большое значение в химии гетероциклических соединений; однако полярография очень мало применялась в препаративной органической химии, хотя полярографические данные могли бы быть весьма полезны при проведении препаративного электролиза. Знание механизма необходимо также при сравнении потенциалов в серии родственных соединений, так как при всех сравнениях и изучении строения требуется один и тот же механизм, особенно при выявлении количественных зависимостей. [48]
На завершающей стадии анализа часто используют прямые потенциометрические измерения. Методика таких измерений проста и состоит только в сравнении потенциала индикаторного электрода в растворе определяемого вещества с потенциалом этого же электрода, погруженного в стандартный раствор того же вещества. Поскольку индикаторный электрод селективен по отношению к определяемому веществу, предварительное разделение не требуется. Наконец, данный метод легко приспособить для непрерывной автоматической записи результатов анализа. [49]
Третий ( трехразрядный с учетом контрольного разряда КЗ) байт проверяется на четность с помощью двухступенчатой схемы свертки. В первой ступени производится сравнение потенциалов с триггеров 16-го и 17-го разрядов, а во второй ступени - сравнение потенциалов с выхода элемента первой ступени и с выхода триггера контрольного разряда КЗ. [50]
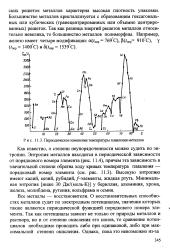 |
Периодическое изменение температуры плавления металлов. [51] |
О восстановительных способностях металлов судят по электродным потенциалам, значения которых также являются периодической функцией порядкового номера элемента. Так как потенциалы зависят не только от природы металлов и раствора, но и от степени окисления его ионов, то сравнение потенциалов необходимо проводить либо при одинаковой, либо при максимальной степени окисления. [52]
Однако окисление аммиака до гидразина может проходить лишь в особых условиях. Как видно из уравнений ( 13) и ( 21) - окисление аммиака до гидразина возможно лишь п-ри высоких анодных потенциалах или при воздействии сильных окислителей. Сравнение потенциалов этих реакций с потенциалами окисления гидразина показывает, что образующийся гидразин будет подвергаться дальнейшему окислению. Поэтому гидразин следует выводить из зоны реакции или превращать в соединение, в котором он окисляется медленно. Реализация возможности получения гидразина окислением аммиака осложняется также тем, что аммиак окисляется до других продуктов, например до азота. [53]
 |
Стационарные потенциалы электродов в растворе Ш N2H4 6 M КОН при 20 С. [54] |
Различие в значениях стационарных потенциалов указывает на то, что характер взаимодействия металла с гидразином во многом определяется химической природой электрода-катализатора. Данные табл. 12 свидетельствуют также о том, что значение потенциала в растворе гидразина для одного и того же металла в сильной степени определяется состоянием его поверхности. Сравнение потенциалов черней и гладких металлов показывает, что потенциалы черней в растворе гидразина более отрицательны, чем потенциалы гладких металлов. [55]
Одноэлектронные переносы на каждой из этих двух ступеней проходят обратимо и быстро. Для таких процессов, как известно [3], полярографический потенциал полуволны очень близок к нормальному окислительно-восстановительному потенциалу. Из сравнения потенциалов следует, что дианион циклооктатетраена является более сильным донором электронов, чем дианион трифенилцианэтилена. Поэтому можно было ожидать, что при взаимодействии дианиона циклооктатетраена с трифенилцианэтиленом пойдет реакция электронного переноса. Соответствующие опыты, проведенные в ТГФ. [56]
ЭЛЕКТРОДЫ СРАВНЕНИЯ - электроды, применяемые при измерении электродных потенциалов в паре с испытуемым электродом. Способы непосредственного измерения потенциала отдельного электрода неизвестны. Поэтому прибегают к сравнению потенциала исследуемого электрода с известным потенциалом другого электрода. Таким электродом является водородный, потенциал к-рого, как известно, принят равным нулю. [57]
При очень низких концентрациях применяют методы полуколичественного определения. Например, при сравнении потенциалов электрода в анализируемом растворе и в растворе сравнения по направлению смещения потенциала можно судить о том, является ли концентрация иона в анализируемом растворе большей или меньшей, чем концентрация этого иона в стандартном растворе. Для нелинейных градуировочных графиков разработаны весьма эффективные вычислительные методы. Однако применение этих методов требует серьезных упрощений, и поэтому получаемые результаты могут значительно отличаться от истинных. [58]
Страницы: 1 2 3 4