Сравнение - потенциал - ионизация
Cтраница 1
Сравнение потенциала ионизации ( C2H5) 3N, определенного в [53], с более точным значением его в [50] указывает, что метод, примененный в [53], дает завышенные результаты. [1]
Сравнение потенциалов ионизации металлов и электронного сродства металлоидов показывает, что почти всегда величина р энергии ионизации несколько превышает электронное сродство. Для случая NaCl превышение составляет 1 3 да. Таким образом, переход электрона от атома Na к атому С1 не может происходить самопроизвольно и требует затраты некоторого количества энергии. С другой стороны, известно, что при образовании молекул выделяется энергия. Чтобы понять, откуда берется энергия, недостающая для ионизации атома щелочного металла, следует учесть, что при сближении ионов выделяется электростатическая энергия их взаимодействия. Образование ионов и их сближение представляет собой единый процесс, происходящий одновременно и лишь после того, как атомы сблизятся настолько, что вместе с образованием ионов выделяется необходимое для этого количество энергии. [2]
Сравнение потенциалов ионизации металлов и электронного сродства металлоидов показывает, что почти всегда энергия ионизации еф несколько превышает электронное сродство. Таким образом, переход электрона от атома Na к атому С1 не может происходить самопроизвольно и требует затраты некоторой энергии. [3]
Сравнение потенциалов ионизации металлов и электронного сродства металлоидов показывает, что почти всегда энергия ионизации eq несколько превышает электронное сродство. Таким образом, переход электрона от атома Na к атому С1 не может происходить самопроизвольно и требует затраты некоторой энергии. [4]
Сравнение потенциалов ионизации изоэлектронных атомарных ионов показывает квадратичную зависимость их от заряда ядра. [5]
 |
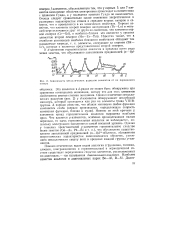
Взаимосвязь между потенциалами ионизации / ( зв некоторых - алканов СпН2п 2 и углеводородов других гомологических рядов. [6] |
На рис. 159 показано сравнение потенциалов ионизации молекул в различных гомологических рядах, органических соединений. [7]
 |
Зависимость металлических радиусов элементов от их порядкового номера. [8] |
Эта аналогия в d - рядах не может быть обнаружена при сравнении потенциалов ионизации, потому что для этих элементов свойственны разные степени окисления. Однако изменение металлических радиусов ( рис. 2) у с ( - элементов обнаруживает неглубокий минимум, который приходится как раз на элементы триад VIIIB-группы. Именно по этой причине у элементов триад горизонтальная аналогия выражена наиболее ярко. Что касается р-элементов, особенно принадлежащих малым периодам, то здесь горизонтальная аналогия не наблюдается, поскольку электронами заполняется самый внешний уровень. [9]
В 5.2 - реакпиях ртутьорганических соединений донором по отношению к электрофилу ( например, протону) выступает именно ст-связь C-Hg, и поэтому на основании сравнения потенциалов ионизации R2Hg и RHgX можно предположить, что диалкипртутные соединения будут более реакционноспособны, чем алкилртутные соли. [10]
 |
Зависимость металлических радиусов элементов от их порядкового номера. [11] |
Для / - элементов горизонтальная аналогия в пределах всего ряда менее заметна, что обусловлено заполнением предвнешней ( и - 1) йболочки. Эта аналогия в rf - рядах не может быть обнаружена при сравнении потенциалов ионизации, потому что для этих элементов свойственны разные степени окисления. Однако изменение металлических радиусов ( рис. 119) у d - элементов обнаруживает неглубокий минимум, который приходится как раз на элементы триад VIIIB-группы. Именно по этой причине у элементов триад горизонтальная аналогия выражена наиболее ярко. Что касается р-элементов, особенно принадлежащих малым периодам, то здесь горизонтальная аналогия не наблюдается, поскольку электронами заполняется самый внешний уровень. [12]
 |
Зависимость металлических радиусов элементов от их порядкового номера. [13] |
Для rf - элементов горизонтальная аналогия в пределах всего ряда менее заметна, что обусловлено заполнением предвнешней ( п - 1) / - оболочки. Эта аналогия в d - рядах не может быть обнаружена при сравнении потенциалов ионизации, потому что для этих элементов свойственны разные степени окисления. Однако изменение металлических радиусов ( рис. 119) у d - элементов обнаруживает неглубокий минимум, который приходится как раз на элементы триад VIIIB-группы. Именно по этой причине у элементов триад горизонтальная аналогия выражена наиболее ярко. Что касается р-элементов, особенно принадлежащих малым периодам, то здесь горизонтальная аналогия не наблюдается, поскольку электронами заполняется самый внешний уровень. Однако у тяжелых представителей р-эле-ментов горизонтальное сходство более заметно ( Ge - As, Pb - Bi и т.п.), что обусловлено существованием предвнешней заполненной ( п - 1) ( Р - оболочкй, сближением энергетических характеристик заполняющихся оболочек, усилением металличности сверху вниз в пределах каждой группы р-элементов. [14]
Однако из строения атома следует, что электроположительный характер элементов главной подгруппы II группы должен быть в среднем несколько слабее, чем у щелочных металлов. Поэтому у последних на внешней оболочке связь оказывается еще более слабой, чем у элементов главной подгруппы II группы. Справедливость этого положения подтверждается сравнением потенциалов ионизации ( табл. 46), полученных из спектроскопических данных, с данными табл. 28 ( стр. Связь электронов на внешней оболочке у металлов щелочноземельной группы прочнее, чем у щелочных металлов, так как атомы последних имеют более высокий эффективный заряд ядра ( ср. [15]
Страницы: 1 2