Сравнение - энтальпие
Cтраница 1
Сравнение энтальпий или изобарных потенциалов различных реакций между соединениями какого-либо класса или ряда, так же как и сравнение констант равновесия, позволяет выбрать те из них, для которых соответствующие величины ( АЯ, AG или 1п р) близки. Если для выбранных реакций соединения обладают тем свойством, что при некоторой классификации структурных фрагментов во всех этих реакциях происходит одинаковое изменение структурных фрагментов, то можно соотнести величины АЯ ( или AG, In Кр) с соответствующими структурными фрагментами, а при исследовании различных реакций и подразделении величин АЯ ( AG, In Кр) на близкие - получить соответствующие парциальные величины для отдельных структурных фрагментов. Такой подход позволяет на основе данных по равновесиям подойти с другой стороны к классификации структурных фрагментов и к установлению того, какие структурные фрагменты можно считать одинаковыми. Подход был развит Бенсоном и Бассом. [1]
Сравнение энтальпий для ряда олиго-адениловых кислот позволяет сделать очень важный вывод - ДЯ в основном определяется разрушением одной пары вертикально связанных оснований. Величина энтальпии изменяется почти независимо от длины цепи. Так, в 0 01 М LiCl ДЯ АФА равна 10 200 кал / моль, а поли - А 12 450 кал / моль. [2]
Сравнение энтальпий образования боридов, силицидов, фосфидов и оксидов ясно показывает, что первые три группы соединений имеют тенденцию к окислению в присутствии кислорода. Однако на практике эти соединения, особенно силициды, проявляют очень высокую стойкость к окислению [48], что дает возможность их использовать для изготовления нагревательных элементов. Согласно Сиарси [48], химическая стойкость этих соединений, вероятно, является результатом покрытия их оксидом кремния. [3]
Сравнение энтальпий образования парафиновых углеводородов и соответствующих радикалов показывает, что практически уже с пропана разница в энтальпиях образования достигает предельного значения, соответствующего 42 ккал / моль. [4]
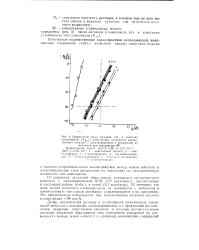 |
Определение числа лигандов ( п н констант устойчивости ( Куст комплексных соединений двухвалентного кобальта с алкилпиридииами и продуктами их. [5] |
Из сравнения энтальпий образования комплексов двухвалентного кобальта с алкилпиридииами ( 0 79 - 2 17 ккал / моль), рассчитанных в настоящей работе ( табл.), и водой ( 2 3 ккал / моль) [5] очевидно, что вода может вытеснять алкилпиридины из комплексов с кобальтом и препятствовать тем самым активации алкилпиридинов и их окислению. Это действительно наблюдается при использовании уксусной кислоты концентрации 98 мас. [6]
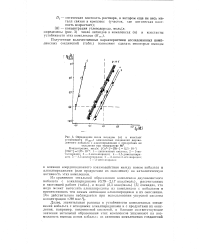 |
Определение числа лигандов ( п и констант устойчивости ( Куст комплексных соединений двухвалентного кобальта с алкнлпиридипами и продуктами их. [7] |
Из сравнения энтальпий образования комплексов двухвалентного кобальта с алкилпиридинами ( 0 79 - 2 17 ккал / моль), рассчитанных Б настоящей работе ( табл.), и водой ( 2 3 ккал / моль) [5] очевидно, что вода может вытеснять алкилпиридины из комплексов с кобальтом и препятствовать тем самым активации алкилпиридинов и их окислению. Это действительно наблюдается при использовании уксусной кислоты концентрации О8 мас. [8]
 |
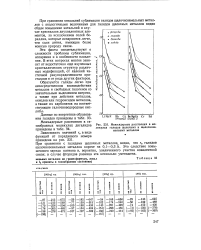
Энтальпии образования гидроксидов щелочных металлов из ( Н2О и твердых окисей. [9] |
При сравнении энтальпий димеризации гидроксидов и галидов видно, что они по величине одного порядка. [10]
 |
Межъядерные расстояния в молекулах галидов щелочных и щелочноземельных металлов. [11] |
При сравнении энтальпий сублимации галидов щелочноземельных металлов с аналогичными величинами для галидов щелочных металлов видно общее повышение энтальпий в случае кристаллов двухвалентных элементов, за исключением солей бериллия, которые испаряются легче, чем соли лития, имеющие более ионную природу связи. [12]
Для того, чтобы облегчить сравнение энтальпий различных реакций, используют понятие стандартного состояния. [13]
Одним из способов проверки предложенной модели влияния заместителей может служить сравнение энтальпий активации в сериях с одинаково варьируемым полярным эффектом заместителя. [14]
 |
Предполагаемые углы между связями в геж-диметилзамещенных циклоалканах. [15] |
Страницы: 1 2