Степень - протекание - реакция
Cтраница 2
Будем считать степень протекания реакции ( обозначим эту величину через) равной нулю, когда реакция еще не началась, и равной единице, когда реакция полностью прошла ( до полного исчерпания веществ, стоящих в левой части уравнения, но вовсе не до наступления равновесия. [16]
 |
Разложение азотнокислотной вытяжки в зависимости от скорости выпаривания. [17] |
При этом степень протекания реакции не превышает 50 %, в соответствии с содержанием в полученных продуктах 20 5 - 22 % PzO5 в водорастворимой форме. С уменьшением длительности процесса увеличивается степень протекания реакции образования дикальцийфосфата. [18]
Известно, что степень протекания реакции слева направо определяется константой равновесия, так как переход электронов в окислительно-восстановительной реакции происходит лишь до тех пор, пока существует разность потенциалов. [19]
Сформулировать, как степень протекания реакции зависит от давления ( стр. [20]
Естественно, что степень протекания реакции при этом мала, и практически рассматриваемый случай не имеет особого интереса, однако влияние газовой среды прослеживается хорошо. [21]
В табл. 1 указана степень протекания реакции за 50 мин при 90 для одинаковых начальных концентраций каждого катализатора с добавкой и без добавки я-толуолсульфокислоты. Нет сомнении, чш одновалентная медь - гораздо более эффективный катализатор, чем двухвалентная. [22]
В табл. 1 указана степень протекания реакции за 50 мин при 90 для одинаковых начальных концентраций каждого катализатора с добавкой и без добавки л-толуолсульфокислоты. Нет сомнения, что одновалентная медь - гораздо более эффективный катализатор, чем двухвалентная. [23]
Если степень гидролиза солей полония сравнима со степенью протекания реакции ( 1), то активным катионом должен являться Ро, а на аноде должна протекать реакция образования двуокиси. [24]
Химические свойства поверхности окислов в основном определяются степенью протекания реакций ( 1) и ( 2), соответствующими стереохимическими особенностями строения и реакционной способностью поверхностных гидроксильных или акво-групп по отношению к разным реагентам, в том числе их бренстедов-скими кислотно-основными свойствами, а также долей открытых атомов металла, создающих льюисовские кислотные центры. Таким образом, химия поверхности окислов при контакте с водой достаточно сложна. Разумно предположить, что поверхностным гидроксильным и акво-группам окислов свойственны такие же реакции, которые известны для нормальных гидроксиакво-катионов. [25]
При стационарном состоянии это выражение можно приравнять к степени протекания реакции в элементарной сферической оболочке с величиной поверхности ( 4ла 26а) Sv, где SD - удельная поверхность, отнесенная к единице объема частицы катализатора. [26]
В методах же Горстманна и Де Донде используется степень протекания реакции как независимая химическая переменная. Но относится ко всей реакции, а не к отдельным ее участникам. [27]
Область, соответствующую первым 5 - 10 % степени протекания реакции, иногда тоже исключают из обработки, но по другим причинам. [28]
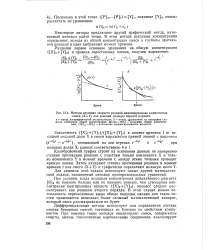 |
Методы изучения скорости реакций индивидуальных компонентов смеси ( X Y для реакций ( псевяо первого порядка. [29] |
Калибровочный график строят на основании данных по измерению степени протекания реакции с участием только компонента X и только компонента Y в момент времени t; между этими точками проводят прямую линию. [30]
Страницы: 1 2 3 4