Сходное электронное строение
Cтраница 2
Подобная близость свойств объясняется тем, что в высшей степени окисленности атомы элементов главных и побочных подгрупп приобретают сходное электронное строение. Аналогично у атома серы, находящегося в степени окисленности 6 ( например, в триоксиде серы SOs), шесть электронов участвуют в образовании ковалентных связей, а конфигурация остальных ( Is22s22p6) также соответствует электронной структуре благородного газа. [16]
Подобная близость свойств объясняется тем, что в высшей тепени окисленности атомы элементов главных и побочных под-рупп приобретают сходное электронное строение. Когда ром находится в степени окисленности 6 ( например, в оксиде Х) 3), шесть электронов его атома ( пять 3d - и один 4-электрон) месте с валентными электронами соседних атомов ( в случае лЮз - атомов кислорода) образуют общие электронные пары, существляющие химические связи. Остальные электроны, непо-редственно не участвующие в образовании связей, имеют конфи-урацию Is22s22p63s23p6, отвечающую электронной структуре бла-ородного газа. Аналогично у атома серы, находящегося в степени кисленности 6 ( например, в триоксиде серы SO3), шесть элек-ронов участвуют в образовании ковалентных связей, а конфигу-ация остальных ( Is22s22p6) также соответствует электронной труктуре благородного газа. [17]
Подобная близость свойств объясняется тем, что в высшей степени окисленности атомы элементов главных и побочных подгрупп приобретают сходное электронное строение. Когда хром находится в степени окисленности 6 ( например, в оксиде СгО3), шесть электронов его атома ( пять 3d - и один 4 -электрон) вместе с валентными электронами соседних атомов ( в случае СгО3 - атомов кислорода) образуют общие электронные пары, осуществляющие химические связи. Остальные электроны, непосредственно не участвующие в образовании связей, имеют конфигурацию Is22s22p63s23p6, отвечающую электронной структуре благородного газа. Аналогично у атома серы, находящегося в степени окисленности 6 ( например, в триоксиде серы SO3), шесть электронов участвуют в образовании ковалентных связей, а конфигурация остальных ( s22s22p6) также соответствует электронной структуре благородного газа. [18]
Подобная близость свойств объясняется тем, что в высшей степени окисленности атомы элементов главных и побочных подгрупп приобретают сходное электронное строение. Когда хром находится в степени окисленности 6 ( например, в оксиде СгО3), шесть электронов его атома ( пять 3d - и один 45-электрон) вместе с валентными электронами соседних атомов ( в случае СгО3 - атомов кислорода) образуют общие электронные пары, осуществляющие химические связи. Остальные электроны, непосредственно не участвующие в образовании связей, имеют конфигурацию Is22s22p63s23p6, отвечающую электронной структуре благородного газа. Аналогично у атома серы, находящегося в степени окисленности 6 ( например, в триоксиде серы SO3), шесть электронов участвуют в образовании ковалентных связей, а конфигурация остальных ( Is22s22p6) также соответствует электронной структуре благородного газа. [19]
Подобная близость свойств объясняется тем, что в высшей степени окисленности атомы элементов главных и побочных подгрупп приобретают сходное электронное строение. Например, атом хрома имеет электронную структуру Is22s22p63s23p63d54slt Когда хром находится в степени окисленности - f - б ( например, в оксиде СгО3), шесть электронов его атома ( пять 3d - и один 45-электрон) вместе с валентными электронами соседних атомов ( в случае СгОз - атомов кислорода) образуют общие электронные пары, осуществляющие химические связи. Остальные электроны, непосредственно не участвующие в образовании связей, имеют конфигурацию Is22s22p63s23p6, отвечающую электронной структуре благородного газа. [20]
Подобная близость свойств объясняется тем, что в высшей степени окисленности атомы элементов главных и побочных подгрупп приобретают сходное электронное строение. Когда хром находится в степени окисленности 6 ( например, в оксиде СгОз), шесть электронов его атома ( пять 3d - и один 45-электрон) вместе с валентными электронами соседних атомов ( в случае СгОз - атомов кислорода) образуют общие электронные пары, осуществляющие химические связи. Остальные электроны, непосредственно не участвующие в образовании связей, имеют конфигурацию Is22s22pe3s23p6, отвечающую электронной структуре благородного газа. [21]
Подобная близость свойств объясняется тем, что в высшей степени окисленности атомы элементов главных и побочных подгрупп приобретают сходное электронное строение. Когда хром находится в степени окисленности 6 ( например, в оксиде СгО3), шесть электронов его атома ( пять 3d - и один 45-электрон) вместе с валентными электронами соседних атомов ( в случае СгО3 - атомов кислорода) образуют общие электронные пары, осуществляющие химические связи. Остальные электроны, непосредственно не участвующие в образовании связей, имеют конфигурацию Is22s22p63s23p6, отвечающую электронной структуре благородного газа. [22]
Подобная близость свойств объясняется тем, что в высшей степени окисленности атомы элементов главных и побочных подгрупп приобретают сходное электронное строение. Когда хром находится в степени окисленности 6 ( например, в оксиде СгО3), шесть электронов его атома ( пять 3d - и один 45-электрон), вместе с валентными электронами соседних атомов ( в случае СгО3 - атомов кислорода) образуют общие электронные пары, осуществляющие химические связи. Остальные электроны, непосредственно не участвующие в образовании связей, имеют конфигурацию Is22s22p63s23p6, отвечающую электронной структуре благородного газа. Аналогично у атома серы, находящегося в степени окисленности 6 ( например, в триоксиде серы 5Оз), шесть электронов участвуют в образовании ковалентных связей, а конфигурация остальных ( Is22s22p6) также соответствует электронной структуре благородного газа. [23]
Подобная близость свойств объясняется тем, что в высшей степени окисленности атомы элементов главных и побочных подгрупп приобретают сходное электронное строение. СгОз - атомов кислорода) образуют общие электронные пары, осуществляющие химические связи. Остальные электроны, непосредственно не участвующие в образовании связей, имеют конфигурацию Is22s22p63s23ps, отвечающую электронной структуре благородного газа. Аналогично у атома серы, находящегося в степени окисленности 6 ( например, в триоксиде серы 5Оз), шесть электронов участвуют в образовании ковалентных связей, а конфигурация остальных ( Is22s22p6) также соответствует электронной структуре благородного газа. [24]
Подобная близость свойств объясняется тем, что в высшей степени окисленности атомы элементов главных и побочных подгрупп приобретают сходное электронное строение. Когда хром находится в степени окисленности 6 ( например, в оксиде СгО3), шесть электронов его атома ( пять 3d - и один 45-электрон) вместе с валентными электронами соседних атомов ( в случае СгОз - атомов кислорода) образуют общие электронные пары, осуществляющие химические связи. Остальные электроны, непосредственно не участвующие в образовании связей, имеют конфи гурацию Is22s22p63s23p6, отвечающую электронной структуре благородного газа. Аналогично у атома серы, находящегося в степени окисленности 6 ( например, в триоксиде серы 5Оз), шесть электронов участвуют в образовании ковалентных связей, а конфигурация остальных ( Is22s22p6) также соответствует электронной структуре благородного газа. [25]
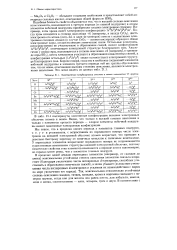 |
Электронные конфигурации атомов и ионов элементов VI группы. [26] |
Подобная близость свойств объясняется тем, что в высшей степени окисления атом элемента, находящегося в третьем периоде ( в главной подгруппе) и атомы элементов побочной подгруппы приобретают сходное электронное строение. Когда хром находится в степени окисления 6 ( например, в оксиде СгОз), шесть электронов его атома ( пять 3d - и один 4з - электрон) вместе с валентными электронами соседних атомов ( в случае СгОз - атомов кислорода) образуют общие электронные пары, осуществляющие химические связи. Остальные электроны, непосредственно не участвующие в образовании связей, имеют конфигурацию Is22s p63s2p6, отвечающую электронной структуре благородного газа. Аналогично у атома серы, находящегося в степени окисления 6 ( например, в триокси-де серы 80з), шесть электронов участвуют в образовании ковалентных связей, а конфигурация остальных ( Is22s2p6) также соответствует электронной структуре благородного газа. Короче говоря, сходство в свойствах соединений элементов побочной подгруппы и элемента третьего периода той же группы обусловлено тем, что их ионы, отвечающие высшим степеням окисления, являются электронными аналогами. [27]
Полными электронными аналогами называются элементы, которые имеют сходное электронное строение во всех степенях окисления, чем и определяется близкое подобие их химических свойств. [28]
Полнилт электронными аналогами называются элементы, которые имеют сходное электронное строение во всех степенях окисления, чем и объясняется близкое подобие их химических свойств. У полония и вольфрама в отличие от остальных элементов присутствует внутренняя завершенная 4 / - оболочка, наличие которой проявляется в лантаноидном сжатии. Поскольку 4 / оболочка располагается глубоко, она мало влияет на свойства и не нарушает характер электронной аналогии. Это значит, что кислород и сера по отношению к остальным элементам VI группы являются неполными электронными аналогами. В то же время аналогия в электронном строении между типическими элементами и подгруппой селена более близкая. Они являются, как отмечено выше, не только групповыми, но и типовыми аналогами. [29]
Полными электронными аналогами называются элементы, которые имеют сходное электронное строение во всех степенях окисления, чем и объясняется близкое подобие их химических свойств. У полония и вольфрама в отличие от остальных элементов присутствует внутренняя завершенная 4 / оболочка, наличие которой проявляется в лантаноидном сжатии. Поскольку 4 / юболочка располагается глубоко, она мало влияет на свойства и не нарушает характер электронной аналогии. Это значит, что кислород и сера по отношению к остальным элементам VI группы являются неполными электронными аналогами. В то же время аналогия в электронном строении между типическими элементами и подгруппой селена более близкая. Они являются, как отмечено выше, не только групповыми, но и типовыми аналогами. [30]
Страницы: 1 2 3