Геометрическое строение - молекула
Cтраница 1
Геометрическое строение молекулы S8 неточно воспроизводится приведенной формулой. [1]
Рассмотрим теперь геометрическое строение молекул. Для экспериментального исследования строения молекул и в ных агрегатных состояниях используют рентгенографию, графию, нейтронографию, ИК-спектры, микроволновую спектроскопию, ядерный магнитный резонанс. [2]
При рассмотрении геометрического строения молекулы наиболее важным фактором являются углы между связями. Теория валентной связи гибридизованных орбиталей дает удовлетворительные величины многих из наблюдаемых углов между связями особенно тогда, когда можно сделать определенный выбор участвующих в связи орбиталей. Однако эта теория не всегда дает объяснения наблюдаемым углам. Ниже будет показано, что этим было, по крайней мере, положено начало лучшему пониманию и объяснению различия углов между связями31 35, которое наблюдается во многих формально аналогичных молекулах. И модель, которая будет использована, по-прежнему базируется, в основном, на пространственной корреляции электронных пар валентного уровня, возникающей из принципа запрета Паули. [3]
При рассмотрении геометрического строения молекулы наиболее важным фактором являются углы между связями. Теория валентной связи гибридизованных орбиталей дает удовлетворительные величины многих из наблюдаемых углов между связями, особенно тогда, когда можно сделать определенный выбор участвующих в связи орбиталей. Однако эта теория не всегда дает объяснения наблюдаемым углам. Ниже будет показано, что этим было по крайней мере положено начало лучшему пониманию и объяснению различия углов между связями31 - 35, которое наблюдается во многих формально аналогичных молекулах. И модель, которая будет использована, по-прежнему базируется в основном на пространственной корреляции электронных пар валентного уровня, возникающей из принципа запрета Паули. [4]
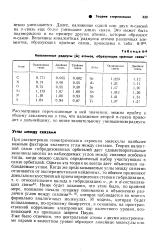 |
Ковалентные радиусы ( А атомов, образующих кратные связи34. [5] |
При рассмотрении геометрического строения молекулы наиболее важным фактором являются углы между связями. Теория валентной связи гибридизованных орбиталей дает удовлетворительные величины многих из наблюдаемых углов между связями особенно тогда, когда можно сделать определенный выбор участвующих в связи орбиталей. Однако эта теория не всегда дает объяснения наблюдаемым углам. Ниже будет показано, что этим было, по крайней мере, положено начало лучшему пониманию и объяснению различия углов между связями31 за, которое наблюдается во многих формально аналогичных молекулах. И модель, которая будет использована, по-прежнему базируется, в основном, на пространственной корреляции электронных пар валентного уровня, возникающей из принципа запрета Паули. [6]
При рассмотрении геометрического строения молекулы наиболее важным фактором являются углы между связями. Теория валентной связи гибридизованных орбиталей дает удовлетворительные величины многих из наблюдаемых углов между связями особенно тогда, когда можно сделать определенный выбор участвующих в связи орбиталей. Однако эта теория не всегда дает объяснения наблюдаемым углам. Ниже будет показано, что этим было, по крайней мере, положено начало лучшему пониманию и объяснению различия углов между связями31 35, которое наблюдается во многих формально аналогичных молекулах. И модель, которая будет использована, по-прежнему базируется, в основном, на пространственной корреляции электронных пар валентного уровня, возникающей из принципа запрета Паули. [7]
Изобразите схемы геометрического строения молекул азидоводорода и азид-иона. Одинаковы или различны длины связей азот - азот в этих частицах. Каким по значению должен быть валентный угол Н - N - N в молекуле азидоводорода. [8]
Вследствие того что геометрическое строение молекул зависит от расположения электронных пар на валентной оболочке, очень важно иметь сведения об их объеме и числе на данной электронной оболочке. Приблизительная оценка объемов электронных пар может быть получена при помощи модели жестких сфер. [9]
На рис. 6.2 изображено геометрическое строение молекулы, соответствующее sp -, sp2 - и 5р3 - гибридизации. Мы должны помнить, однако, что ни метод молекулярных орбиталей, ни представление о гибридизации не могут строго доказать, что структуры СН2, СН3 или СН4 действительно обязаны быть такими, какими они оказались по экспериментальным данным. Ценность этих принципов состоит в том, что, будучи сформулированными для некоторых конкретных структур, они позволяют предсказывать структуры и других молекул на основании рассмотрения орбиталей, способных к образованию связи. Поскольку при определении химических свойств молекулы ее геометрическое строение играет важную роль, такая теория является существенным шагом вперед к более глубокому пониманию химии. [10]
Очень плодотворным методом изучения геометрического строения молекулы ( взаимного расположения центров атомов и углов между связями) является метод рентгеноструктурного анализа кристаллов органических веществ. Он основан на том, что всякое вещество обладает способностью рассеивать падаю: щее на него излучение, в том числе рентгеновское. При этом рассеяние рентгеновских лучей кристаллами находится в определенном соответствии с расположением атомов в кристалле. [11]
Очень плодотворным методом изучения геометрического строения молекулы ( взаимного расположения центров атомов и углов между связями) является метод рентгеноструктурного анализа кристаллов органических веществ. Он основан на том, что всякое вещество обладает способностью рассеивать падающее на него излучение, в том числе рентгеновское. При этом рассеяние рентгеновских лучей кристаллами находится в определенном соответствии с расположением атомов в кристалле. [12]
Объем молекулы рассчитывается из геометрического строения молекулы и атомных радиусов. Величина отношения объем кристалла / число молекул определяется из рентгенографического эксперимента. [13]
Пространственные эффекты связаны с геометрическим строением молекулы: объемами атомов, длинами связей, валентными и двугранными углами. [14]
Анализ теории и методов расчета геометрического строения молекул приводит к выводу о том, что квантовая механика служит в данном случае лишь основой для понимания физического содержания закономерностей, установленных экспериментально. [15]
Страницы: 1 2 3 4