Структура - димер
Cтраница 2
Контакты в кристаллах конканавалина А, инсулина и а-химо-трипсина помогают в определении структуры димеров в растворе. [16]
В основе углеводородов ряда трицикло ( 5 2 1 02в) декана лежит структура гидрированного димера циклопентадиена. Поэтому наиболее удобным методом синтеза этих углеводородов является использование доступного трициклодекадиена. [17]
Димеризация в определенных условиях может также происходить путем полимеризации мономеров. Структура димеров [ А12 ( Н2О) 8 ( ОН) 2 ] 4 состоит из двух октаэдров, соединенных по ребру. [18]
Структура димеров H выяснена. [19]
Фосфорный ангидрид получают сжиганием фосфора ( см. гл. Известен он в виде нескольких модификаций: летучая имеет структуру димера Р4Ою, нелетучие обладают координационным строением. Диаграмма состояния включает два расплава и несколько твердых фаз, так как нелетучие модификации имеют различные кристаллические решетки. Технический продукт состоит из смеси летучей и нелетучих модификаций, остающихся после отгона Р4Эю в виде твердой, спекшейся массы. [20]
 |
Константы и теплоты диссоциации димера трифенилметила.| Диссоциация димеров триарилметилов. [21] |
Данные, представленные в табл. 2.6, показывают, сколь сильно зависит диссоциация димеров от природы заместителя. Ал-килзаме ] щенные триарилметилы не димеризуются даже при низкой температуре [121], что подтверждает циклогексадиеновую структуру димера. [22]
В соответствии с результатами анализа и изучения инфракрасного спектра, а также по аналогии этому соединению была приписана структура циклического мономера. Инфракрасный спектр менее летучего компонента оказался практически идентичным спектру мономера, и в соответствии с аналитическими данными, а также летучестью ему приписана структура димера. [23]
Некоторые я, 3-непредельные кетоны под влиянием энолизующих веществ так же, как и альдегиды, способны к диеновой димеризации с образованием карбоциклических димеров. Так, Брауде и сотрудники [374] установили, что окись мезитила ( XVI) в присутствии лития испытывает сложные превращения и наряду с другими продуктами с выходом около 30 % дает димер ( XVII), образующийся в результате конденсации энолята ( XVIa) с молеку - - лой исходного кетона. Структура димера ( XVII) была доказана дегидратацией в кетоны ( XVIII) и ( XIX), дегидрированием в 2 3 4 6-тетраметил - ацетофенон ( XX) и подтверждена спектроскопически. [24]
Некоторые а р-непредельные кетоны под влиянием энолизующих веществ так же, как и альдегиды, способны к диеновой димеризации с образованием карбоциклических димеров. Так, Брауде и сотрудники [374] установили, что окись мезитила ( XVI) в присутствии лития испытывает сложные превращения и наряду с другими продуктами с выходом около 30 % дает димер ( XVII), образующийся в результате конденсации энолята ( XVIa) с молекулой исходного кетона. Структура димера ( XVII) была доказана дегидратацией в кетоны ( XVIII) и ( XIX), дегидрированием в 2 3 4 6-тетраметил-ацетофенон ( XX) и подтверждена спектроскопически. [25]
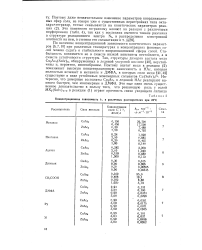 |
Концентрационная зависимость kv в различных растворителях при 25 С. [26] |
Стабильность понимается не в смысле низкой константы нестойкости, а в смысле устойчивости структуры. Так, структуры димеров ацетата меди Си2Ас4 ( 5о1у) б, обнаруженных в ледяной уксусной кислоте [40], неустойчивы и, вероятно, многообразны. Интересно, что димерные ассоциаты Си2Ас4 в ледяной НАс реагируют намного быстрее, чем мономерные в ДМФА. [27]
Этот комплекс представляет собой дибромтетрафенил-циклобутадиенникель. Взаимодействие Ni ( GO) 4 с трифенилциклопропенил-бромидом дает NiBr ( CO) C3 ( C6H5) 3, который, как полагают, является тг-цик-лопропенильным комплексом никеля. Было высказано предположение, что это соединение имеет структуру димера с мостиковыми атомами галогена. [28]
При обычной температуре фосфорный ангидрид представляет собой белое кристаллическое вещество. Он гигроскопичен и является одним из наиболее интенсивных осушителей газов. Фосфорный ангидрид известен в виде нескольких модификаций: летучая имеет структуру димера Р4Ою, нелетучие обладают координационным строением. Диаграмма состояния включает два расплава и несколько твердых фаз, так как нелетучие модификации имеют различные кристаллические решетки. Технический продукт состоит из смеси летучей и нелетучих модификаций, остающихся после отгона Р4Ою в виде твердой, спекшейся массы. [29]
Хлорид и бромид весьма близки по своим свойствам; оба соединения имеют красно-коричневый цвет, сильно гигроскопичны и летучи. В газообразном состоянии до 700 хлорид железа ( Ш) имеет структуру димера [ 61, подобно галогениду алюминия; выше 700 преобладающей становится мономерная форма. Однако в твердом состоянии хлорид же-леза ( Ш) не сохраняет димерной структуры. [30]
Страницы: 1 2 3