Структура - жидкая вода
Cтраница 3
Такое число гидратации находится в соответствии с представлениями о структуре жидкой воды и позволяет представить механизм гидратации состоящим в замещении ионом центральной молекулы воды в ее тетраэдр ической ячейке. Капустинский предполагает, что при гидратации катионы оттягивают от кислорода четырех молекул воды четыре пары электронов, в результате чего вокруг катиона образуется дополнительный слой из восьми электронов. Увеличение радиуса гидратированного иона по сравнению с кристаллографическим на 0 28 А автор теории объясняет тем, что, как им было установлено, толщина восьмиэлектронного слоя ( за исключением слоя К) составляет 0 20 А, а разница в 0 08 А является следствием различия в координации ионов в кристаллической решетке и в растворе. Соответственно при гидратации анионов происходит оттягивание четырех пар электронов благодаря образованию водородных связей с четырьмя молекулами воды. Этому соответствует уменьшение размеров анионов на 0 28 А. [31]
Вода в прочно адсорбированном состоянии обладает структурой, отличной-и от структуры обычной жидкой воды и от структуры обычного льда. Для молекул, находящихся в таком состоянии, переход к структуре льда мог бы потребовать разрыва сравнительно прочных связей или искажения валентных углов и не сопровождался бы повышением устойчивости структуры не только при 0 С, но и при значительно более низких температурах. В тех же случаях, когда несколько более слабая связь адсорбированных молекул не будет препятствовать переходу их к структуре льда, выделение теплоты и изменение объема при этом процессе могут отличаться по величине от эффектов, наблюдаемых при кристаллизации льда из свободной воды, и соотношение между ними может быть иным. [32]
Бернал и Фаулер ( 1932), основываясь на результатах рентгеновского исследования структуры жидкой воды, впервые показали, что связи между молекулами и относительные расположения их в жидкой воде в определенной степени подобны имеющимся в структуре льда. Они различали при этом Структуры, сходные со структурами разных кристаллических модификаций SiO2 - кварца и тридимита. [33]
В водном растворе энергия взаимодействия компонентов зависит от влияния органических молекул на структуру жидкой воды. Суммарным проявлением этих взаимодействий является величина растворимости. Поэтому коэффициенты активности компонентов в адсорбционной фазе могут быть выражены через растворимость веществ и энергию их диполь-дипольного ( или ионного) взаимодействия, характер которого в адсорбционной фазе может существенно отличаться от взаимодействия в жидкости из-за фиксированной ориентации на границе раздела фаз. Активность органических молекул в водных растворах при небольшой их растворимости с достаточным приближением учитывается степенью их ионизации. То обстоятельство, что водородные связи в водных растворах низкомолекулярных веществ играют основную роль, значительно облегчило понимание условий равновесия на границе раздела водный раствор - неполярный адсорбент и нахождение наиболее вероятной ориентации адсорбированных из раствора органических молекул. [34]
Структура воды, адсорбированной на различных поверхностях, естественно, должна отличаться от структуры жидкой воды. Опыт показывает, что пористые стекла являются сильными адсорбентами водяных паров в полупроводниковых приборах. Ренд [129], исследовавший адсорбцию воды пористым стеклом Vycor в интервале температур от 30 до 150 С и давлений от 0 1 до 3300 Па, пришел к выводу, что поведение молекул воды в адсорбционной пленке является промежуточным между поведением жестко связанных и полностью подвижных молекул. На основании данных ЯМР и диэлектрических измерений Элфорд [45] делает вывод, что вода в непосредственной близости от поверхности белков и других макромолекул in vivo и in vitro частично ориентирована, а ее подвижность ограничена. Он показал, что при охлаждении мышцы морской свинки от 37 до - 7 С почти вся внутриклеточная вода остается осмотически активной. [35]
Обзор обширных результатов по исследованию структуры воды приводит Саймонса [81] к выводу, что структура жидкой воды именно такая, которую следует ожидать, исходя из электронной структуры мономерной воды. Жидкая вода имеет нормальную электронную структуру, и вытекающие из этого химические и физические свойства не следует считать аномальными. Автор сделал расчет для случая, когда вода растворена в некотором гипотетическом инертном растворителе. При низких концентрациях растворенная вода имеет мономерные молекулы. При увеличении концентрации начинается образование димеров. При наличии димеров мономерные молекулы с большей вероятностью присоединяются к дилерам и образуют тримеры, чем соединяются между собой. Поскольку добавление к ассоциату каждой новой молекулы приводит к появлению еще двух активных центров, к которым могут присоединиться другие молекулы, то при неизменных внешних условиях все молекулы воды могли бы образовать один гигантский полимер. [36]
В последние годы становится все более популярной идея о существенной роли димерных молекул в формировании структуры жидкой воды. Так, Викке [26] считает, что димерные молекулы воды являются третьим состоянием воды. Сложность его двухструктурной модели, однако, едва ли делает ее более совершенной, чем модели О. Я. Самойлова и Фрэнка и Вина, а экспериментальных прямых доказательств эта теория, как и другие, по существу не имеет. [37]
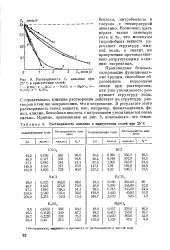 |
Растворимость анилина в присутствии солей при 25 С.| Растворимость Cs 25 С в присутствии солей. [38] |
Возможно, здесь играет также заметную роль и то, что молекулы гидрофобных веществ укрепляют структуру жидкой воды, а значит, их присутствие противодействует разрушающему влиянию нагревания. [39]
Присутствие в воде веществ ионной природы, таких, как NaCl, приводит к заметному изменению структуры жидкой воды. Это обусловлено тем, что каждый ион ( в частности, ионы Na и Cl -) окружен гидрат-ной оболочкой, состоящей из дипольных молекул воды, причем геометрия и свойства таких гидратированных ионов несколько отличаются от геометрии и свойств ассоциатов ( кластеров), образуемых молекулами воды за счет водородных связей; гидратированные ионы имеют более упорядоченную и более регулярную структуру. Таким образом, растворенные соли стремятся разрушить нормальную структуру жидкой воды и изменить ее свойства как растворителя. Ниже мы увидим, что растворимость белков резко уменьшается при повышении концентрации нейтральных солей, например NaCl, Na2SO4 и ( NH4) 2SO4, изменяющих свойства воды и снижающих ее способность растворять белки. Такое влияние растворенных нейтральных солей может быть использовано для разделения смеси белков, поскольку многие белки различаются по своей способности осаждаться из солевых растворов. [40]
Поэтому целесообразно до теоретического анализа адсорбции и обсуждения экспериментального материала по адсорбции растворенных в воде веществ рассмотреть современные представления о структуре жидкой воды и водных растворов. [41]
Исследование растворимости углеводородов в воде, водных растворах неэлектролитов и электролитов имеет большое теоретическое и практическое значение в связи с изучением структуры жидкой воды и водных растворов и совершенствованием процессов разделения и очистки углеводородов различной степени ненасыщенности. [42]
С удлинением углеводородных радикалов молекул ПАВ так же, как и с уменьшением растворимости углеводорода в воде, ослабляется их влияние на структуру жидкой воды и потому ослабевает влияние солюбилизации на критическую концентрацию мицеллообразования. Молекулы ПАВ с короткими углеводородными цепями не могут создать достаточно большие углеводородные области внутри мицелл, поэтому при длине углеводородной цепи молекул менее семи углеродных атомов явление солюбилизации не наблюдается. [43]
Наилучшее объяснение [107] основывается на хорошо известном факте, состоящем в том, что ионы Н30 и ОН - чрезвычайно хорошо входят в структуру жидкой воды и, следовательно, более сильно сольватированы, чем большинство других кислот и оснований. Однако важно заметить, что этот замедляющий скорость эффект будет действовать лишь в том случае, когда субстрат сам не образует прочных водородных связей с растворителем, так как в противном случае станет возможным перенос протона по цепному механизму Гротгуса, при котором десольватация не является необходимой. [44]
Инфракрасные спектры воды, измеренные в интервале температур от комнатной до величины, лежащей выше критической [46], не поддаются однозначной интерпретации, хотя есть основание предполагать, что при высоких температурах вся структура жидкой воды разрушается. Два пика, возникающие в спектре при температуре выше 200, можно отнести за счет влияния vi и V2, причем сопоставление положения этих пиков с соответствующими спектрами разбавленного водяного пара свидетельствует о том, что ОН-осцилляторы продолжают испытывать влияние значительных сил взаимодействия. В интервале промежуточных температур непрерывное изменение формы и частоты полос спектра не позволяет использовать полученные данные для толкования структурных изменений, происходящих в жидкости. Исследование свойств HDO в аналогичных условиях, очевидно, позволит разрешить ряд сомнений в отношении природы полос в спектре воды при высоких температурах [14, 47], поскольку в случае HDO появляется возможность проследить колебания отдельных ОН - ( или OD -) групп. Частоты валентных колебаний ОН - и OD-rpynn сильно отличаются друг от друга и не сливаются. Подобное разделение частот может возникнуть и в жидкой воде. В том случае, когда один атом водорода молекулы воды связан сильной направленной водородной связью, а второй атом остается в свободном состоянии, можно ожидать, что частоты двух осцилляторов ОН будут достаточно различны для того, чтобы ослабить или предотвратить межмолекулярное механическое слияние. В этом случае, очевидно, симметричность молекулы будет снижаться от С2 до Cs, а спектр будет отражать валентные колебания лишь свободной ОН-группы. [45]
Страницы: 1 2 3 4