Структура - гемоглобин
Cтраница 2
 |
Параметры, характеризующие спиральные участки молекулы миоглобина. [16] |
Гемоглобин - кислородпереносящий пигмент крови млекопитающих - в структурном отношении гораздо сложнее миоглобина, хотя он и близок к нему. При изучении структуры гемоглобина был использован почти такой же подход, как и в случае миоглобина. Однако хотя работы эти были начаты на несколько лет раньше, чем опыты с миоглобином, детальную структуру гемоглобина вследствие ее большей сложности удалось расшифровать только в самое последнее время. [17]
Из всех имеющихся структурных данных для оксигевиро-ванного и неокснгенированного гемоглобинов можно сделать вывод, что-третичная структура гемоглобина не имеет видоспецифичности. [18]
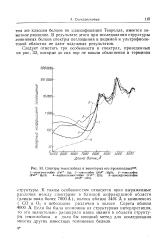 |
Спектры гемоглобина и некоторых его производных101. [19] |
К таким особенностям относятся ярко выраженные различия между спектрами в близкой инфракрасной области ( длины волн более 7000А), полоса вблизи 340С А в комплексах с СО и О2 и небольшие различия в полосе Сорета вблизи 4000 А. Если бы была возможна их структурная интерпретация, то это значительно расширило наши знания в области структуры гемоглобина и дало бы мощный метод для исследования многих других известных геминовых белков. [20]
В настоящее время все шире завоевывает себе признание теория биологической универсальности: важнейшие биохимические процессы одни и те же для всех клеток без исключения. Структуры, участвующие в реакциях, построены из одних и тех же типов молекул и вступают в сходные реакции. Так, несомненным является принципиальное сходство структур гемоглобина и хлорофилла, содержащих в одном случае катион железа, а в другом - магния. Почти всегда для накопления и хранения энергии служит молекула аде-нозинтрифосфорной кислоты; в реакциях, ведущих к освобождению запасенной энергии, как один из видов топлива используется D-глю-коза. [21]
У позвоночных гемоглобин не просто растворен; он сильно сконцентрирован в эритроцитах. В мышечных клетках содержится очень похожий па гемоглобин пигмент - миоглобин. Структура штоглобина изучена гораздо более подробно, чем структура гемоглобина. Поскольку он содержит только одну простетическую группу тема на молекулу, кривая кислородного насыщения имеет вид гиперболы. Близки к миоглобину гемо-глобины, найденные в клетках крови некоторых примитивных позвоночных, например миног. Эти белки имеют молекулярный вес 17 500 и содержат только один гем на молекулу. Разнообразные дыхательные пигменты обнаружены у беспозвоночных. К ним: относятся эритрокруорины - высокопо-лимерпые гемоглобиноподобные молекулы, которые присутствуют не в форменных элементах, а в жидкой фазе крови некоторых кольчатых червей ( полихет и олигохет) и моллюсков. Молекулярный вес эритрокруоринов колеблется в пределах, от 4 - Ю5 до 6 7 - 106; эти белки содержат от 30 до 400 гемогрупп на молекулу. В крови других кольчатых червей ( например, у Spirographis) содержатся зеленые гемопротеиды, называемые хлорокруо-ринами. Их молекулярный вес равен 3 5 - 10е; каждая молекула содержит 190 групп хлорокруорогема ( см. фиг. Независимо от размера все эти гемопротеиды связывают по одной молекуле 02 на каждую группу тема. [22]
Гемоглобины животных значительно отличаются от гемоглобина человека по аминокислотному составу. Однако все они успешно выполняют функцию транспорта кислорода. Несмотря на различия в аминокислотном составе вторичная и третичная структуры гемоглобинов из различных источников подобны. N-Концевые аминокислоты у ряда гемоглобинов также одинаковы. [23]
К составным белкам, а конкретно к металлопротеидам, относятся близкие по своей структуре миоглобин и гемоглобин. Эти глобулярные белки содержат небелковую компоненту, пигмент крови - гем ( разд. Степень окисления железа при таком переносе не изменяется, и оно остается двухвалентным. Структура миоглобина более простая, чем структура гемоглобина. В растительном мире ( Rhizobium) известен гемопротеид - леггемоглобин, который по своей структуре близок к миоглобину. [24]
 |
Схематическое изображение синтеза РНК по матрице ДНК. ( Воспроизведено с разрешения Macmillan Publishing Co., Inc., из Chemical Biology by J. Ramsey Bronk. Copyright 1973, J. Ramsey Bronk. [25] |
Любое изменение в кодоне приведет к мутации, причем многие мутации гибельны для организма. Лучше всего изучены мутации, которые вызывают изменение структуры гемоглобина. [26]
Следует отметить, что многие из этих концепций были введены и математически формализованы до того, как стала известна структура какого-либо белка. Очевидно поэтому актуальное значение и полезность этих концепций должны подвергаться постоянной проверке. Пример дифосфоглицерата, влияние которого на действие и структуру гемоглобина игнорировалось десятилетиями, свидетельствует о потенциальной опасности жестких формулировок в биологии. [27]
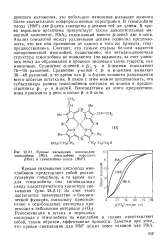 |
Кривые насыщения кислородом 100 миоглобина ( Mb, гемоглобина взрослого ( НЬА и гемоглобина плода ( HbF. [28] |
В гемоглобине плода ( HbF) две р-цепи замещены у-цепями той же длины. В крови взрослого организма присутствует также дополнительный минорный компонент, НЬАз, содержащий вместо р-цепей две 6-цепи. Считают, что самым старым белком является однрцепочечный миоглобин; существенно, что четырехцепочечная структура гемоглобина не появляется ( по-видимому, за счет удвоения гена) до образования в процессе эволюции таких существ, как миноговые. Сравнение а-цепей с р -, - у - и 6-цепями показывает 76 - 95 различий. Сравнение уцелей с р - и 6-цепями выявляет 36 - 48 различий, в то время как р - и б-цепи человека различаются всего десятью остатками. [29]
В 1962 году ученый был удостоен Нобелевской премии по химии вместе с Максом Перу-цем, который изучал структуру гемоглобина. [30]
Страницы: 1 2 3