Электронная структура - атом
Cтраница 1
Электронные структуры атомов и ионов меди, серебра и золота. [1]
Электронная структура атомов ( по крайней мере, их возбужденные состояния) может быть определена с привлечением метода эффективной массы ( МЭМ), когда доноры рассматриваются как водородоподобные атомы ( или им подобные) [ 91; 24 гл. Однако данные об энергии основного состояния согласно МЭМ для доноров VI группы приблизительно на порядок меньше экспериментальных. Это объясняется вероятностью существования электронных состояний вблизи ядра примеси ( 15 - и 2з - состояния), где реальный потенциал сильнее, чем экранированный кулоновский, полученный МЭМ. Взаимодействие Is-электрона с этим потенциалом приводит к понижению уровня основного состояния на величину, зависящую от природы примеси. В отличие от основного возбужденные состояния ( р-состояния) не столь чувствительны к короткодействующему основному потенциалу, поэтому достаточно хорошо описываются МЭМ. [2]
Электронная структура атомов элементов подгруппы меди может быть выражена формулой... [3]
Электронную структуру атома можно схематически представить электронно-точечным символом, в котором электроны внешней оболочки ( или внешнего октета) указывают точками, а ядро вместе с внутренними электронами обозначают химическим символом данного элемента. Электронно-точечный символ лития ( Li -) показывает только внешний электрон, который называют валентным электроном. [4]
Электронную структуру атома можно схематически записать в виде электронно-точечных символов, в которых электроны внешней оболочки ( или внешнего октета) представляются точками, а ядро и внутренние электроны обозначаются химическим символом данного элемента. Электронно-точечный символ лития Li показывает только внешний электрон, называемый валентным. [5]
Вся электронная структура атома: общее число электронов в атоме, число электронных оболочек, число электронов в каждой электронной оболочке и число электронов в самой наружной электронной оболочке, оказывающее наибольшее влияние на химические свойства элемента, - вся эта структура в конечном счете определяется величиной положительного заряда ядра атома. Величина эта, как мы знаем, выражается порядковым номером элемента. Таким образом, величина заряда ядра является тем основным свойством элемента, от которого зависят другие его свойства. Следовательно, не масса атома ( его атомный вес) определяет свойства элемента, как считали Д. И. Менделеев и современные ему ученые, а величина положительного заряда его ядра. [6]
Рассмотрев электронные структуры атомов, необходимо остановиться теперь на электронных структурах ионов. Вообще при образовании положительных ионов электроны удаляются с орбит атома, соответствующих наиболее высокой энергии. В случае переходных металлов наибольшую энергию имеют внешние s - электроны, и, следовательно, атом теряет их первыми. [7]
Определить электронные структуры атомов элементов 2 периода, выразить их электронными формулами и графически. [8]
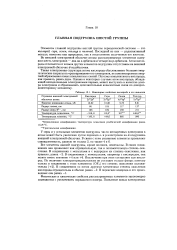 |
Некоторые свойства кислорода и его аналогов. [9] |
Такая электронная структура атома кислорода обусловливает большие энергетические затраты на распаривание его электронов, не компенсируемые энергией образования новых ковалентных связей. Поэтому ковалентность кислорода, как правило, равна двум. Однако в некоторых случаях атом кислорода, обладающий неподеленными электронными парами, может выступать в качестве донора электронов и образовывать дополнительные ковалентные связи по донорно-акцепторному механизму. [10]
Сопоставление электронных структур атомов и химических свойств элементов дает возможность сделать вывод, что в первых семи группах по подгруппам, а в восьмой и нулевой по группам элементы сходны между собой вследствие аналогичного построения двух, а у лантаноидов и актиноидов трех наружных электронных уровней их атомов. В атоме электроны занимают такое положение, которое соответствует большей энергии их связи с ядром. Этим можно объяснить, что 19 - й электрон атома калия и 20 - й электрон атома кальция занимают положение s - подуровня четвертого энергетического уровня, хотя подуровень d третьего энергетического уровня еще не заполнен. Только после того, как на подуровне s четвертого энергетического уровня будут находиться два электрона, очередные десять электронов начинают размещаться на подуровне d третьего энергетического уровня. [11]
Исследование электронной структуры атомов позволило доказать, что причиной периодического повторения свойств элементов с возрастанием порядкового номера является периодическое повторение процесса постройки новых электронных оболочек. К одной группе периодической системы всегда принадлежат те элементы, у атомов которых в наружных оболочках находится одинаковое число электронов. Так, атомы всех инертных газов, кроме гелия, содержат по 8 электронов в наружной оболочке и Труднее всех ионизируются, между тем как атомы щелочных металлов содержат по одному электрону в наружной оболочке и обладают наиболее низким ионизационным потенциалом. Щелочные металлы только с одним электроном во внешней оболочке могут легко его терять, переходя в устойчивую форму положительного иона с электронной конфигурацией, подобной ближайшему инертному газу с меньшим порядковым номером. Такие элементы, как фтор, хлор и др., по числу внешних электронов приближающиеся к конфигурации инертных газов, наоборот стремятся приобрести электроны и воспроизвести эту электронную конфигурацию, переходя в соответствующий отрицательный ион. [12]
Изучив электронную структуру атома, нам остается привести некоторые сведения о строении и свойствах его ядра. Действительно, наряду с химическими реакциями, в которых принимают участие только электроны внешних оболочек, существуют различные реакции, так называемые ядерные реакции, в которых изменению подвергаются ядра атомов. [13]
Сравните электронную структуру атомов хрома и серы. Какие степени окисления реализуются для этих элементов. В какой степени окисления эти элементы проявляют сходство в свойствах. [14]
Аналогично развиваются электронные структуры атомов в VII незавершенном периоде. У франция и радия новые электроны поступают в подуровень 7s внешнего слоя, у актиния - в подуровень 6Р предпоследнего слоя, у актиноидов - в подуровень 5 / третьего от периферии слоя, пока он не заполнятся до 32 электронов. Затем у курчатовия новый электрон поступает в подуровень 6d предпоследнего слоя. [15]
Страницы: 1 2 3 4