Электронная структура - инертный газ
Cтраница 2
Известны многочисленные соединения, в которых кальций двухвалентен и электроположителен. Ион кальция Са2 бесцветен, имеет электронную структуру инертного газа и в большинстве соединений гидратирован. Соединения кальция, как правило, бесцветны, хорошо растворяются в воде, плохо-в спирте. Мало растворимые соединения: окись, гидроокись, фторид, карбонат, оксалат, трехзамещенный орто-фосфат, гексацианоферрат кальция и аммония, хелатное соединение иона кальция Са2 с пикриновой кислотой и с 7-иодо - 8-оксихино-лин - 5-сульфоновой кислотой. [16]
Для ионов металлов, образующих комплексы преимущественно ионного характера, устойчивость комплексов увеличивается с ростом заряда и уменьшением размера негидратированного иона металла. Это справедливо для ионов металлов, имеющих электронную структуру инертных газов и для лантаноидов. В ряду лантаноидов размер ионов уменьшается и устойчивость комплексов увеличивается с ростом атомного номера. [17]
Для металлов, образующих комплексы преимущественно ионного характера, устойчивость этих комплексов возрастает с увеличением зарядности и уменьшением размера ( негидратирован-ного) иона металла. Это положение выполняется в отношении металлов, имеющих электронную структуру инертных газов, и лантанидов. [18]
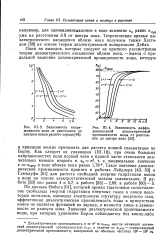 |
Зависимость напряженности поля от расстояния до центров ионов разного заряда.| Зависимость дифференциальной диэлектрической проницаемости воды от расстояния до центра иона. [19] |
Как следует из уравнения ( III. Такое значение диэлектрической проницаемости принято в работах Лейдлера [43, 53] и Глюкауфа [51] для расчета свободной энергии гидратации ионов в воде на основе электростатической модели сольватации. По данным Нойеса [61], который провел тщательное сопоставление свободных энергий гидратации инертных газов и ионов некоторых металлов, имеющих электронную структуру инертного газа, эффективная диэлектрическая проницаемость воды в присутствии ионов не является функцией их заряда, а меняется лишь в зависимости от радиуса иона. [20]
Коссель предложил теорию ионной связи, согласно которой наиболее устойчивыми электронными структурами являются структуры инертных газов и все элементы охотно отдают лишние по отношению к этим структурам электроны или принимают недостающие для электронных структур инертных газов. Между катионами и анионами возникает простое электростатическое притяжение, проявляющееся прежде всего в создании ионной кристаллической решетки. При попадании такого кристалла в растворитель силы притяжения ослабевают пропорционально его диэлектрической проницаемости, и ионы, сохраняя свою индивидуальность, переходят в раствор. [21]
Наши сведения о ядерных спиновых квантовых числах основаны на результатах экспериментов. Ядра, содержащие некоторое магическое число нуклонов ( протонов и нейтронов) - 2, 8, 20, 28, 50, 82 и 126, необычайно устойчивы. При этом нетрудно заметить определенную аналогию с электронными структурами инертных газов. Можно постулировать, что ядро имеет систему стационарных энергетических уровней. [22]
Сильными восстановителями являются такие химические элементы, которые при потере одного электрона образуют устойчивую электронную конфигурацию инертных газов. Такого рода элементы находятся в группе I А2 периодической таблицы Менделеева; это Li, Na, К, Rb и Cs. Элементы группы 1Б также теряют один электрон, образуя положительный ион, несущий один заряд, однако другие причины лимитируют их восстановительную силу. На своей внешней электронной оболочке элементы группы IA имеют один электрон, который весьма легко отдается с образованием однозарядного положительного иона. Такой ион имеет электронную структуру инертного газа. [23]
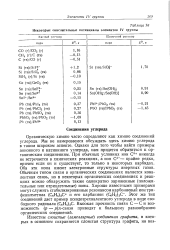 |
Некоторые окислительные потенциалы элементов IV группы. [24] |
Органическую химию часто определяют как химию соединений углерода. При обычных условиях ион С4 никогда не встречается в химических реакциях, а ион С4 - - крайне редко, причем если он и существует, то только в некоторых карбидах. Оба эти иона имеют электронные структуры инертных газов. Обычным типом связи в органических соединениях является кова-лентная связь, но в некоторых органических соединениях и реакциях можно обнаружить также однократно заряженные ( положительные или отрицательные) ионы. Высокая прочность связи С-Си возможность ( р - р) я-связи приводят к большому разнообразию органических соединений. [25]
Строение электронных оболочек атомов и ионов позволяет объяснить и предсказать действия многих реагентов. Если рассмотреть деление периодической системы на четыре блока ( s - блок, р-блок, d - блок и f - блок), элементы of - блока и f - блока образуют комплексные соединения. Для них также характерно взаимодействие с органическими реагентами и образование большого числа окрашенных соединений. Цирконий и торий ( d - и f - блок) образуют с арсеназо III устойчивые комплексные соединения зеленого цвета. Магний и алюминий ( s - и р-блок) не взаимодействуют с арсеназо III. В s - блоке расположены элементы, в которых строится s - оболочка над электронной структурой инертного газа - это щелочные и щелочноземельные элементы. [26]
Поскольку актиний трудно выделить из природных источников, исследователи давно пришли к выводу, что химические свойства актиния очень близки к химическим свойствам лантана и редкоземельных элементов. Актиний, как и редкоземельные элементы, образует не растворимые в воде фторид, гидроокись, оксалат, карбонат и фосфат. Физические свойства галогенидов актиния, насколько они изучены, очень похожи на свойства соответствующих галогенидов редких земель. Все те чистые соединения актиния, которые были приготовлены и охарактеризованы, изострук-турны с соответствующими соединениями лантана. Кристалло-химические исследования показали, что размеры иона Ас3 наибольшие из всех известных трехзарядных ионов; радиус его равен 1 10 А. Ионный радиус лантана равен 1 06 А, небольшое различие ионных радиусов ( 0 04 А), наряду с тем фактом, что оба иона имеют аналогичную электронную структуру инертного газа, в равной мере обусловливает сходство химических свойств. Заключение о подобии актиния и редких земель подтверждается его поведением при соосаждении с носителями. [27]
Страницы: 1 2