Адденд
Cтраница 1
 |
Некоторые реакции иуклеофильного и электрофильного замещения а. [1] |
Адденд ( аммиак) представляет собой нуклеофилышй реагент ( см. разд. Вероятно, он присоединяется вследствие своей нуклеофильности; неноделенные электроны азота атакуют ядро атома углерода карбонильной группы; в дальнейшем реакция завершается благодаря легкости переноса протона к неподеленному электрону атома кислорода. [2]
Адденд ( хлористый водород) относится к электрофильным реагентам ( см. разд. Предположим, что он присоединяется вследствие своей электрофильности, соединяясь своим протоном и я-электронами атома углерода: при этом реакция заканчивается благодаря легкости присоединения хлор-иона к другому атому углерода, которому теперь не хватает электрона. [3]
Адденд, будучи элек-трофильным, атакует в первую очередь атомы, богатые электронами. Следовательно, в случае, например, бутадиена каждая из винильных групп является электроположительной по отношению к другой и обладает - - Е - эффек-том, поэтому электроны концевых атомов становятся наиболее доступными для присоединяющегося протона. [4]
Важнейшими аддендами являются: а) нейтральные молекулы, имеющие дипольный характер: ЬЬО, NH3, NO и др., б) ионы: CN -, NO - C1 -, Br -, J -, ОН -, СС. [5]
Давно известными аддендами такого рода являются диазоалканы. Центральный атом их трехатомной ненасыщенной системы обладает псевдооснов-ностыо и, следовательно, будет делить свой положительный заряд с одним из двух концевых атомов, в то время как на другом концевом атоме будет сосредотачиваться такой же по величине отрицательный заряд. [6]
Если адденд обладает постоянным диполем, прочность его связи с ионом-комплексообразователем повышается параллельно с увеличением деформируемости последнего. [7]
Координация аддендов, содержащих в качестве донора другие элементы, для бериллия, магния, кальция, стронция и бария не характерна. [8]
Анион адденда в том и другом случаях атакует р-утлеродный атом. [9]
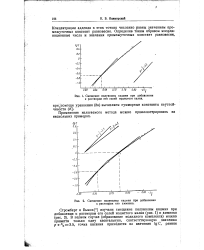 |
Смещение полуволны кадмия при добавлении к растворам его солей ирдистого калия.| Смещение полуволны кадмия при добавлении к растворам его аммиака. [10] |
Концентрации адденда в этих точках численно равны значениям промежуточных констант равновесия. [11]
Число аддендов ( атомов, ионов, молекул), расположенных вокруг комплексообразователя, называется координационным числом. Согласно теории Вернера, для каждого иона характерно максимальное координационное число. У многих металлов оно равно шести. Однако, не всегда координационное число у данного центрального атома имеет постоянное значение. [12]
Количество аддендов, связанных с комплексообразо-вателем, называется координационным числом. [13]
Размещением аддендов и силой их трансвлияния и предопределяется, какой из наличных аддендов при реакции замещения во внутренней сфере подвергнется замещению. [14]
Анион адденда в том и другом случаях атакует - углеродный атом. [15]
Страницы: 1 2 3 4