Сукцинатдегидрогеназа
Cтраница 3
Кролики гибнут после 7 - 12 введений по 3 0 г / кг и после второго введения 4 0 г / кг. При меньшей дозе анемия и лейкоцитоз, торможение активности сукцинатдегидрогеназы и цитохромоксидазы. [31]
При остром отравлении значительную роль в механизме действия эфира играет кислородное голодание вследствие снижения окислительно-восстановительных процессов. Это подтверждается гистохимически установленным разрушением митохондриальных мембран и снижением активности сукцинатдегидрогеназы и цитохромоксидазы в тканях головного мозга и внутренних органов. [32]
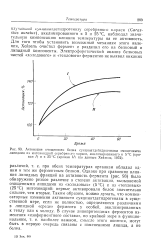 |
Активация очищенного белка сукцинатдегидрогеназы очищенными липидами из митохондрий серебряного карася, акклимированного к 5 С ( кривая / и к 25 С ( кривая / / ( по данным Хейзеля, 1972. [33] |
Однако при сравнении влияния липидных фракций на активность фермента ( рис. 93) было обнаружено резкое различие в степени активации, вызываемой очищенными липидами из Холодовых ( 5 С) и из тепловых ( 25 С) митохондрий: первые активировали белок значительно сильнее, чем вторые. Таким образом, можно думать, что компенсаторные изменения активности сукцинатдегидрогеназы в существенной мере, если не полностью, определяются различиями в липидной среде фермента у особей, акклимированных к теплу или к холоду. [34]
Пии 0 01 мг / л у Животных отмечено увеличение окислен-ного и общего глютатиона в крови, снижение уровня неорганического фосфора и активности щелочной фосфа-тазы в сыворотке крови. Установлено также изменение экспрессии бромсульфалеина из организма, а также снижение активности сукцинатдегидрогеназы в ткани печени. При воздействии селена в концентрации на уровне 0 001 мг / л не обнаружено влияния на организм животных ни по одному из использованных в хроническом опыте тестов. Поэтому гигиенический норматив селена в питьевой воде принят на этом уровне. [35]
Ферментное ингибирование в присутствии олигомеров кремневой кислоты может быть следствием либо направленности активных центров фермента в сторону кремнеземной поверхности, либо денатурации молекулы фермента по механизму Марголиса. Кинг и др. [280] сообщили, что подобным образом ингибируются ацетпл-холинэстераза, сукцинатдегидрогеназа, эстераза и гиалурони-даза; не подвержены ингибированию амилаза, панкреатическая липаза, пепсин, щелочные и кислые фосфатазы, трипсин и уреаза. [36]
Еще один тип дыхания, где конечным акцептором служит органическое вещество, называется фумаратным дыханием. К фума-ратному дыханию способны практически все микроорганизмы, имеющие электронтранспортную цепь с сукцинатдегидрогеназой. Это энтеробактерии, вибрионы и пропионовые бактерии: 2 [ Н ] фумарат - сукцинат. При этом цепь переноса электронов очень короткая, при восстановлении 1 М фумарата образуется 1 М АТФ, так как есть только один пункт сопряжения, где происходит окислительное фосфорилирование. [37]
Сукцинатдегидрогеназа катализирует превращение сукцина-та в фумаровую кислоту. Фермент вмонтирован во внутреннюю мембрану митохондрий и в качестве простетической группы содержит ФАД. Сукцинатдегидрогеназа - регуляторный фермент: активируется фосфатом, сукцинатом и конкурентно ингибируется ЩУК, последней дикарбоновой кислотой ЦТК. [38]
Сукцинат: убихинон-редуктаза ( СУР) катализирует окисление сукцината убихиноном. По данным электрофореза, в полиакриламид-ном геле в присутствии додецилсульфата натрия фермент состоит из 3 - - 4 полипептидов. Да) придают сукцинатдегидрогеназе реактивность по отношению к убихинону, чувствительность к специфическим ингибиторам и, по-видимому, принимают участие в связывании фермента с мембраной. Выделение препарата СУР основано на экстракции фермента из мембраны с помощью неионного детергента тритона Х-100 и концентрировании препарата охлажденным ацетоном. Дальнейшее фракционирование сульфатом аммония и очистка на кальций-фосфатном геле позволяют получить фермент в высокоочищенном состоянии с каталитической активностью около 25 мкмоль окисленного сукцината в 1 мин на 1 мг белка. [39]
В комплекс I входит дегидрогеназа восстановленного НАД ( флаво-протеид, ФП4) и белки, которые содержат негемное железо ( 2 - 8 атомов железа на молекулу) и остатки цистеина, специфическим образом связанные с железом. В комплекс II также входят флавопротеид ( сукци-натдегидрогеназа, ФП2) и белки, содержащие негемное железо. Дегидрогеназа восстановленного НАД и сукцинатдегидрогеназа по молекулярной структуре и механизму действия сходны между собой. Оба эти фермента относятся к высокомолекулярным белковым комплексам. [40]
 |
Установка для солюбилиза-ции сукцинатдегидрогеназы. [41] |
В колбу помещают мешалку, продувают азотом, закрывают, хорошо перемешивают до полной гомогенности суспензии. Смесь центрифугируют 15 мин в закрытом стакане при 5000 об / мин в центрифуге ЦБР. Полученный желтый прозрачный супернатант представляет собой раствор частично очищенной сукцинатдегидрогеназы. Раствор оставляют под слабым током азота при 0 С и используют сразу после получения. [42]
Известны и другие примеры такого рода разделения внутриклеточного пространства на отдельные отсеки. Внутримитохондриальный аце-тил - КоА, сам по себе диффундирующий наружу с большим трудом, сначала превращается в цитрат, а затем последний в цитоплазме расщепляется с образованием ацетил - КоА, который теперь может быть использован для реакций, происходящих в этой части клетки. Добавленные извне сукцинат и малонат свободно поступают к митохондриальной сукцинатдегидрогеназе. Совсем не так обстоит, однако, дело с фумаратом и оксалоацетатом. Мито-хондриальная фумараза также непосредственно недоступна для добавленного фумарата. [43]
Сукцинатоксидазная система интактных митохондрий состоит по крайней мере из шести индивидуальных компонентов - переносчиков электронов: флавопротеида, кофермента Qio ( KpQ), цитохромов в, с, с и цитохромоксидазы. В 40 - х годах Кейлину удалось показать, что при обработке субмитохондриальных фрагментов щелочью происходит необратимая потеря сукцинатоксидазной активности, тогда как цито-хромоксидазная активность в этих условиях остается практически неизменной. Эти эксперименты положили начало серии исследований, в результате которых были осуществлены выделение растворимой сукцинатдегидрогеназы и реконструкция сукцинатдегидрогеназной системы из дегидрогеназы и мембран, содержащих кофермент Q и цитохромы. [44]
Сукци-натдегидрогеназа способна связывать в активном центре оксалоацетат с чрезвычайно высоким сродством. Процесс диссоциации ингибитора очень медленный, особенно при низких температурах. В свази с этим при измерении любых активностей митохондриальных ферментов, в которых участвует дегидрирование сукцината, необходимо быть уверенным, что сукцинатдегидрогеназа находится в активном состоянии. Пре-инкубацию проводят при - 30 С в течение 30 мин. За это время происходит полное вытеснение оксалоацетата из активного центра фермента. Этот процесс называют активацией сукцинатдегидрогеназы. [45]
Страницы: 1 2 3 4