Сульфат - окисное железо
Cтраница 1
Сульфат окисного железа Fe2 ( S04) 3 выделяется в виде белого или желтоватого порошка при действии на окись железа концентрированной серной кислотой. С водой он образует рад кристаллогидратов, присоединяя до 10 молекул кристаллизационной воды. В фармацевтической работе находит применение водный раствор сульфата окисного железа ( Ferrum sulfuricum oxydatum solutum), идущий для приготовления противоядия от мышьяка. [1]
Из раствора сульфата окисного железа приготовляют гидрат окиси. Свежеосажденный гидрат окиси применяется в медицине в качестве противоядия при отравлении мышьяком. [2]
Доказано, что растворы сульфата окисного железа являются сильным катализатором процесса окисления ЗОг в SO3; некоторое окисление SO2 имеет место даже при высокой температуре в результате каталитического действия летучей золы. Однако наиболее интенсивное окисление SO2 происходит при высокой температуре на поверхности, покрытой слоем влаги, насыщенной сульфатом окисного железа; образование серной кислоты идет здесь очень быстро, и вышеупомянутый слой жидкости всегда должен иметь высокую концентрацию кислоты. [3]
Действие серной кислоты и раствора сульфата окисного железа на сталь дает сульфат закисного железа, который немедленно превращается в сульфат окисного железа под действием дымовых газов, содержащих SCb. Таким образом, SOz, составляющая большую часть продуктов сгорания серы, содержавшейся в угле, участвует в процессе коррозии, превращаясь в серную кислоту под действием насыщенного раствора сульфата окисного железа. Доказано, что коррозия металла, даже опрыскиваемого серной кислотой, мала по сравнению с коррозией, вызываемой комбинированным действием кислой реакции и окислительных свойств влажной пленки сульфата окисного железа. [4]
Вместо квасцов можно взять 50 г сульфата окисного железа. [5]
К охлажденному раствору приливают 25 мл раствора сульфата окисного железа и медленно, при непрерывном переме: шивании приливают 20 мл концентрированной серной кислоты. Раствор нагревают до кипения и держат на умеренном огне 4 - 5 минут. Горячий раствор переливают в литровую колбу, в которую предварительно наливают 300 мл воды. [6]
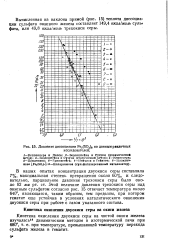 |
Давление диссоциации Fe2 ( SO4 a по данным различных. [7] |
Вычисленная из наклона прямой ( рис. 15) теплота диссоциации сульфата окисного железа составляет 149 4 ккал. [8]
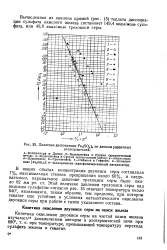 |
Давление диссоциации Fea ( SO4 3 по данным различных исследователей. [9] |
Вычисленная из наклона прямой ( рис. 15) теплота диссоциации сульфата окисного железа составляет 149 4 ккал / моль сульфата, или 49 8 ккал / моль трехокиси серы. [10]
По мнению других авторов [68], катализатором для образования S03 является сульфат окисного железа на поверхности пароперегревателя. [11]
Действие серной кислоты и раствора сульфата окисного железа на сталь дает сульфат закисного железа, который немедленно превращается в сульфат окисного железа под действием дымовых газов, содержащих SCb. Таким образом, SOz, составляющая большую часть продуктов сгорания серы, содержавшейся в угле, участвует в процессе коррозии, превращаясь в серную кислоту под действием насыщенного раствора сульфата окисного железа. Доказано, что коррозия металла, даже опрыскиваемого серной кислотой, мала по сравнению с коррозией, вызываемой комбинированным действием кислой реакции и окислительных свойств влажной пленки сульфата окисного железа. [12]
Определению мешают: растворимые аэрозоли щелочей с 4 мкг и более в пересчете на ион гидроксила в 5 мл; сульфат окисного железа. Определению не мешают: этанол, аэрозоли, не растворимые в воде, ароматические монокарбоновые кислоты бензольного ряда. [13]
При наличии некоторых других анионов последние также адсорбируются в большей или меньшей степени; к таким анионам относятся ванадий, молибден, анионный комплекс сульфата окисного железа, хлорат, кобальтицианид и политионаты. Некоторые из этих анионов удаляются вместе с ураном во время последующих операций по элюированию ( регенерации) и вызы вают лишь незначительное уменьшение емкости ионита по отношению к урану, однако имеются и такие анионы, которые являются серьезными ядами для ионообменной смолы. Эти яды, как например политионаты, кобальтоцианиды и молибден, не могут быть полностью удалены при помощи обычного элюирова-ния и постепенно накапливаются, что приводит к большим потерям емкости и к уменьшению скорости реакции ионного обмена. [14]
Ионы хлора в азотнокислом растворе осаждаются нитратом серебра в виде хлорида серебра, избыток последнего оттитровывают раствором роданида калия или аммония в присутствии индикатора - сульфата окисного железа. Для установления конца реакции титрование ведут в присутствии толуола. [15]
Страницы: 1 2