Сульфат - индий
Cтраница 2
Растворимость сульфата индия сильно зависит от концентрации серной кислоты. При концентрации H2SO4 более 55 % растворимость сульфата индия составляет всего 0 5 %, при этом из раствора выделяется кислая соль. Осаждение индия из сернокислых растворов путем высаливания серной кислотой может быть использовано для очистки индия от примесей. [16]
Изучение процесса окисления сульфидов индия и таллия показало [573], что интенсивное окисление сульфида индия In2S3 начинается при температуре около 400 С и проходит очень. С, причем продуктами окисления являются 1п2О3 и SO2; сульфат индия обнаруживается в продукте окисления лишь в ничтожных количествах. Окисление сульфида таллия T12S, наоборот, приводит к образованию сульфата таллия. Окисление T12S начинается при 282 С, при 445 С материал начинает оплавляться, причем скорость окисления снижается, & при 595 С материал полностью возгоняется. [17]
Сразу же после травления производят нанесение выводов эмиттера и коллектора. Для этого в качестве электролита берут соль какого-либо металла, обычно сульфат индия или хлористый индий. [18]
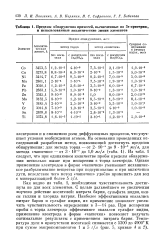 |
Пределы обнаружения примесей, вычисленные по Зв-критерию, и использованные аналитические линии элементов. [19] |
Как видно из табл. 1, необходимая чувствительность достигнута не для всех элементов. С целью дальнейшего ее увеличения изучено действие носителей: нитрата бария, сульфата индия, окиси галлия и хлорида натрия. Наиболее эффективными оказались нитрат бария и сульфат индия, их применение позволяет увеличить чувствительность определения в 3 - 14 раз. При испарении пробы с торца электрода эффективнее оказался сульфат индия, применение электрода в форме чашечки позволяет получать оптимальные результаты с применением нитрата бария. [20]
Для изготовления триодов с поверхностными барьерами были выработаны специальные приемы. На кристалл и - Qe с противоположных сторон направляются непрерывные струи электролита ( раствор сульфата индия), и между электродом, введенным в электролит, и Ое накладывается напряжение такого знака, что Ge электролитически стравливается и на его поверхности в месте попадания струек образуются две лунки. После достижения надлежащей глубины лунок знак напряжения меняется, на поверхности Ge начинает откладываться In и в результате получается структура, показанная в разрезе на рис. 599, а. [21]
Из приведенных в табл. 2.3 пределов обнаружения примесей видно, что не для всех элементов достигнута необходимая чувствительность. Для дальнейшего снижения пределов обнаружения микропримесей изучено действие ряда носителей: нитрата бария, сульфата индия оксида галлия, хлорида натрия. [23]
Перенос дырок через пластинку, очевидно, не будет различным для обоих барьеров. Было установлено, что эта величина остается неизменной при изменении температуры от 15 до 60 С, концентрации КОН от 0 01 до 10 %, удельном сопротивлении материала электронной проводимости от 0 2 до 6 ом см, световых токах от 0 1 до 1 0 ма / см2 и для 0 1 N раствора сульфата индия. [24]
Индий имеет наибольшее сходство с галлием и алюминием, а также с кадмием и оловом. Амфотерный характер гидроокиси индия выражен значительно слабее, чем гидроокисей галлия и алюминия; водные растворы солей индия гидролизованы ме - нее сильно, чем растворы соответствующих солей галлия и алюминия; сульфид индия 1п28з, в отличие от сульфидов галлия и алюминия, устойчив в присутствии воды. Сульфат индия, так же как и сульфаты алюминия и галлия, образует двойные соли с сульфатами калия, рубидия, цезия н аммония. Индий существенно отличается от галлия и других трехвалентных металлов тем, что он осаждается в форме сульфида из слабокислого раствора. [25]
Сернокислые соли Ga3 и его аналогов бесцветны и легкорастворимы в воде. Безводная соль переходит в ОааОз выше 700 С. Сульфат индия из нейтральных растворов выделяется с ЮНдО, а при избытке HsS04 - в виде комплексной кислоты HIInfSO al SVzHsO. Близкий по составу кристаллогидрат - H [ Tl ( SO4Ja ] 4H20 - образует и таллий. [26]
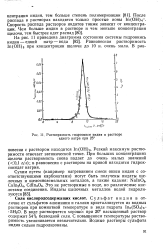 |
Растворимость гидроокиси индия в растворе едкого натра при 25. [27] |
В воде растворяется хорошо: при 20 насыщенный раствор содержит 54 % безводной соли. С повышением температуры растворимость увеличивается незначительно. Водные растворы сульфата индия сильно гидролизованы. [28]
Токсическими свойствами обладают его растворимые в воде соединения. Хлорид индия ( III) прижигает слизистую оболочку глаз и слабо раздражает кожу. Минимальная смертельная доза сульфата индия для кроликов при введении внутрь составляет 1 3 - 2 0 г / кг массы при экспозиции 5 - 12 сут. [29]
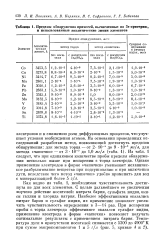 |
Пределы обнаружения примесей, вычисленные по Зв-критерию, и использованные аналитические линии элементов. [30] |
Страницы: 1 2 3