Существование - пересыщенный раствор
Cтраница 2
Явление пересыщения было установлено впервые Т. Е. Ловицем ( 1795), который открыл существование пересыщенных растворов и изучал их. Возможность существования их связана с затруднениями в возникновении зародышей новой фазы, так. С этим же в большей или меньшей степени связана и сохраняемость метастабильных кристаллических фаз и стеклообразного состояния. [16]
Явление пересыщения было установлено ( 1795) впервые Т. Е. Ловицем, который открыл существование пересыщенных растворов и изучал их. Возможность существования их связана с затруднениями в возникновении зародышей новой фазы, так как очень малый ( в первый момент) размер выделяющихся частичек новой фазы увеличивает изотермические потенциалы вещества и делает эти частички менее устойчивыми. С этим же в большей или меньшей степени связана и сохраняемость метаста-бильных кристаллических фаз и стеклообразного состояния. [17]
Явление пересыщения было установлено ( 1795) впервые Т. Е. Ловицем, который открыл существование пересыщенных растворов и изучал их. Возможность существования их связана с затруднениями в возникновении зародышей новой фа з ы, так как очень малый ( в первый момент) размер выделяющихся частичек новой фазы увеличивает изотермические потенциалы вещества и делает эти частички менее устойчивыми. С этим же в большей или меньшей степени связана и сохраняемость метастабильных кристаллических фаз и стеклообразного состояния. [18]
Так как соли лейкосоединений некоторых красителей ( например, кубовый синий О) мало растворимы и легко кристаллизуются даже при незначительном понижении температуры ( что практически невозможно полностью исключить в производственной практике), то в состав выпускной формы красителя вводят специальные добавки, замедляющие кристаллизацию и, таким образом, удлиняющие время существования пересыщенного раствора. [19]
Зародыши кристаллов самопроизвольно образуются лишь в пересыщенном растворе. На рис. 2 - 1 представлена диаграмма состояний раствора [ 41, с. Пространство между двумя сплошными кривыми характеризует область существования пересыщенного раствора, где он может находиться в псевдоравновесном состоянии достаточно длительное время. Нижняя кривая - зависимость растворимости вещества от температуры. При этом скорость выпадения осадка настолько велика, что образующаяся твердая фаза представлена в основном глобулами аморфного вещества, которые постепенно кристаллизуются в процессе старения осадка. [20]
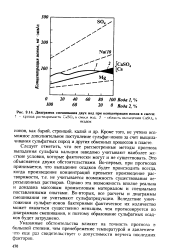 |
Диаграмма смешивания двух вод при концентрации ионов в смеси. [21] |
Следует отметить, что все рассмотренные методы прогноза выпадения сульфата кальция заведомо учитывают наиболее жесткие условия, которые фактически могут и не существовать. Это объясняется двумя обстоятельствами. Во-первых, при прогнозах принимается, что выпадение осадков будет происходить всегда, когда произведение концентраций превысит произведение растворимости, т.е. не учитывается возможность существования пересыщенных растворов. Однако эта возможность вполне реальна и доказана массовым промысловым материалом и специально поставленными опытами. Во-вторых, все расчеты и диаграммы смешивания не учитывают сульфатредукции. Вследствие уничтожения сульфат-ионов бактериями фактическое их количество может оказаться существенно меньшим, чем прогнозируется по диаграммам смешивания, и поэтому образование сульфатных осадков будет затруднено. [22]
Страницы: 1 2