Координационная сфера
Cтраница 2
Если координационная сфера иона РЗЭ заполняется одним или несколькими лигандами более низкой дентантности, естественно, хелатный эффект оказывается меньше, так как число частиц в системе в результате комплексообразования изменяется мало. [16]
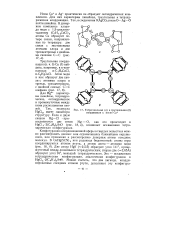 |
Тетрагональная ( а и тригональная ( б координация у ионов Си. [17] |
Конфигурацию координационной сферы в твердых веществах можно рассматривать двояко: или ограничиваясь ближайшим окружением, или привлекая к рассмотрению донорные атомы соседних молекул. Две связи HgS ( - 2 бА) образуют угол 141, промежуточный между линейным и тетраэдрическим; вторые две ( - 2 6бА) образуют угол 94, меньший тетраэдрического. [18]
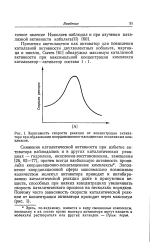 |
Зависимость скорости реакции от концентрации активатора при образовании координационно-насыщенных неактивных комплексов. [19] |
Заполнение координационной сферы максимально возможным количеством молекул активатора приводит к ингибиро-ванию каталитической реакции даже в присутствии веществ, способных при низких концентрациях увеличивать скорость каталитического процесса на несколько порядков. [20]
 |
Последовательные координационные феры F-центра в кристалле. [21] |
Номер координационной сферы представляет собой сумму квадратов миллеровских индексов точки относительно места захвата электрона. [22]
Изменение координационной сферы вследствие присоединения лиганда в ряде случаев превращает необычные спектры в спектры, характерные для симметричных комплексов. [23]
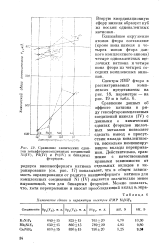 |
Сравнение химических сдвигов гексафторокомплексных соединений Ni ( IV, Pd ( IV и Pt ( IV и бинарных фторидов. [24] |
Вторую координационную сферу никеля образует куб из восьми одновалентных катионов. [25]
В высокосимметричную координационную сферу центрального атома гетерополикислоты ( разд. [26]
В координационной сфере л - комплекса LXXVII ( схема 27.9) имеются два объемистых трифенилфосфииовых лиганда ( телесный угол 145; см. раздел 27.8), и поэтому образуется преимуществеиио неразветвленный металлалкил LXXVIII, т.к. разветвленные алкильные соединения неустойчивы из-за пространственных эффектов. Но если один из фосфииовых лигандов заменить на значительно меньшую по размерам молекулу СО, то в интермедиате LXXVIII становится возможным образование изопропильной группы. [27]
В ближней координационной сфере каждой молекулы СО2 находятся 12 других молекул. Эту структуру можно рассматривать как плотнейшую упаковку молекул СО2, центры тяжести которых образуют кубическую гранецентрированную решетку. [28]
В координационной сфере иоиа металла располагается определенное число лигаидов, это число и есть координационное число комплексообразователя. Координационные числа в принципе переменны и определяются природой металла и лигаида, хотя для каждого иоиа металла имеются характерные для него координационные числа. Очень многие иоиы металлов образуют плоские квадратные или тетраэдрические комплексы с координационным числом четыре или октаэдри-ческие комплексы с координационным числом шесть. Координационные числа 2 и 3, и больше шести - 7, 8, 9 встречаются реже. Комплексы с максимальным числом лигаидов называют координационно насыщенными. [29]
Очевидно, координационная сфера разрушается в тем большей степени, чем выше AGo6p гидратированного комплекса по сравнению с AGo6p совокупности отдельных гидратированных частиц, образующихся при его распаде. [30]
Страницы: 1 2 3 4