Аденилат
Cтраница 1
Аденилаты аминокислот, так же как и ацилфосфаты аминокислот, обладают высокой реакционной способностью, так как содержат макроэргическую фосфатную связь, но в отличие от ацилфосфатов они гораздо более устойчивы в водной среде. [1]
Аденилаты ATP, ADP, AMP и СоА - производные жирных кислот оказывают регулирующее воздействие на многие реакции, участвующие в катаболизме гексоз, в промежуточном обмене и в синтезе запасных веществ. Регуляция фосфофруктокиназы служит, по-видимому, тем главным клапаном, с помощью которого регулируется поток субстрата, направляемый по фруктозобисфосфатному пути. Соответствующий фермент, контролирующий у некоторых бактерий расщепление субстрата по 2-кето - 3-дезокси - 6-фосфоглюконатному пути-это, очевидно, глюкозо-6 - фосфатдегидрогеназа. [2]
Образование аденилатов аминокислот катализируется особыми, так называемыми активирующими ферментами. Известно, что в состав белковых молекул чаще всего входит около 20 различных аминокислот. Для каждой аминокислоты имеется свой активирующий фермент, и, таким образом, в синтезе белковых молекул участвуют одновременно 20 активирующих ферментов. [3]
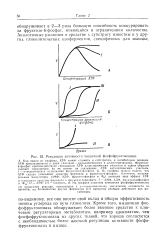
НАД и НАДФ опять-таки являются аденилатами, производными адснина. На рис. 2.7 показаны взаимопревращения НАД и НАД. [4]
Приведенные примеры подтверждают предположения о том, что аденилаты выполняют в клетке важные регуляторные функции и что они в известной степени представляют собой общие для катаболизма и анаболизма сигналы, обеспечивающие нужное соотношение между получением энергии и процессами биосинтеза. Внутриклеточное содержание ATP, ADP и AMP ( или, точнее, соотношение между этими тремя аденилатами) определяет скорость отдельных реакций, а тем самым и сложных процессов распада и синтеза. [5]
Действие ПТГ на ткани саязано с активацией им аденилат циклазы. [6]
У других организмов солевые АТФазы подвержены сильному модулирующему действию аденилатов, специфических фосфолипидов и, возможно, двухвалентных катионов, но в отношении рыб систематического изучения этих эффектов не проводилось. И наконец, активность ферментов слишком часто исследовали при неподходящей температуре ( 37 С); выбор столь небиологических условий может вести к совершенно неверным представлениям о фундаментальных регуляторных взаимодействиях. Очевидно, что все эти вопросы еще требуют изучения. [7]
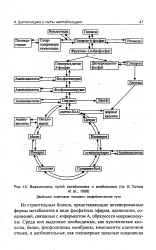 |
Взаимосвязь путей катаболизма и анаболизма ( по G. Tortora. [8] |
Из строительных блоков, представляющих активированные формы метаболитов в виде фосфатных эфиров, аденилатов, соединений, связанных С коферментом А, образуются макромолекулы. [9]
Без этой концевой тройки нуклеотидов молекулы р - РНК неспособны к реакции с аденилатами аминокислот, и поэтому, перед тем как вступать в реакцию с аденилатом аминокислоты, молекулы р - РНК должны быть активированы. Активирование заключается в присоединении к цепи р - РНК трех нуклеотидов. [10]
Результаты проведенных исследований позволяют предполагать, что аллостерические ферменты активируются или ингибируются тем или иным аденилатом и что именно это обеспечивает согласованную регуляцию всего метаболизма клетки. Если, например, энергетический заряд клетки возрастает, то активность катаболических ферментов снижается, а активность ферментов, участвующих в процессах синтеза, увеличивается. При уменьшении энергетического заряда наблюдается обратная картина. [11]
Кроме того, мышечная фос-фофруктокиназа обнаруживает более высокое сродство к ключевым регуляторным метаболитам, например аденилатам, чем фосфофруктокиназы из других тканей, что хорошо согласуется с необходимостью более жесткой регуляции активности фосфофруктокиназы в мышце. [13]
Далее реакция с АТФ, аналогичная реакции (IV.47), катализируемая панто-теинфосфат аденилилтрансферазой, приводит к переносу остатка аденилата на 4 -фосфат ( 89) с образованием дефосфокофермента А, который после фосфорили-рования дефосфокофермент А кинаэой по 3 -гидроксигруппе аденилового фрагмента дает кофермент А. [14]
Страницы: 1 2 3