Аденилат
Cтраница 2
Кроме того, в скелетных мышцах при напряженной работе важное значение приобретает и такой процесс, как дезаминирование аденилата ( AMP), тоже являющегося источником аммиака. [16]
Для превращения неактивной формы в активную необходимо присутствие особого фермента, а также Mg2 и аденозин-3 5 -фосфата ( циклического аденилата; см. гл. Образование аденозин-3 5 -фосфата из АТФ катализируется специфичным ферментом аденилциклазой, активность которого стимулируется адреналином - гормоном, представляющим собой катехоламин. Известно, что адреналин является мощным стимулятором катаболизма гликогена in vivo; он вызывает превращение гликогена в глюкозу, которая поступает в кровь; избыточное поступление глюкозы в кровь ведет к гипергликемии. [17]
 |
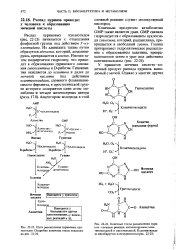
Происхождение атомов, образующих пуриновое ядро. Выяснено на основании экспериментов с использованием предшественников, меченных изотопами 14С или 15N. [18] |
Два обычных пуриновых нуклеотида, входящих в состав нуклеиновых кислот-это аденозин-5 - монофосфат ( AMP), называемый также аденилатом, и гуано-зин-5 - монофосфат ( СМР), или гуанилат. В состав этих нуклеотидов входят пури-новые основания-соответственно аденин и гуанин. [19]
Перенос АМФ он осуществлять не может, и для ликвидации АМФ, образующегося внутри митохондрий, в межмембранном пространстве находится аденилат киназа, переводящая монофосфат в дифосфат. [20]
Активность многих ферментов, участвующих в энергетическом обмене клетки, по крайней мере частично регулируется энергетическим статусом клетки, причем главными метаболическими сигналами служат аденилаты. В мышце устрицы реакции, катализируемые обоими интересующими нас ферментами, ведут к образованию высокоэнергетических фосфатов ( АТФ в случае пируваткиназы и ИТФ или ГТФ - в случае фосфоенолпируваткарбоксикиназы), и обе они подвержены ингибированию своим продуктом. В этом отношении оба фермента ведут себя в соответствии с концепцией энергетического заряда Эткин-сона. Такой механизм, несомненно, способствует физиологическому равновесию в точке разветвления пути фосфоенолпирувата, но сам по себе он не обладает достаточной специфичностью, чтобы им можно было объяснить переход от аэробного обмена к анаэробному. Необходимая специфичность может быть привнесена ионами Н и L-аланином. [21]
В отличие от синтеза пептидов, при активировании аминокислот образуется не ацилфосфат и АДФ, а комплексное соединение аминокислоты с адениловой кислотой ( так называемый аденилат аминокислоты) и выделяется неорганический пиро-фосфат. [22]
Без этой концевой тройки нуклеотидов молекулы р - РНК неспособны к реакции с аденилатами аминокислот, и поэтому, перед тем как вступать в реакцию с аденилатом аминокислоты, молекулы р - РНК должны быть активированы. Активирование заключается в присоединении к цепи р - РНК трех нуклеотидов. [23]
АМФ), который регулирует; : ферментативные реакции в клетках, запасающих сахара и жиры. Этот аденилат присутствует в клетках в количествах, на три порядка меньших, чем АТФ; цАМФ возникает из АТФ и в свою очередь превращается в инертный нециклический АМФ. Эти малые Количества цАМФ все же на два-три порядка больше количества гормона и обеспечивают более чем стократное усиление внешнего гормонального сигнала, воздействующего на клетку. [24]
Распад пуриновых нуклеотидов ( рис. 22 - 23) начинается с отщепления фосфатной группы под действием 5 -ну-клеотидазы. Из аденилата таким путем образуется аденозин, который, дезамини-руясь, превращается в инозин. Инозин затем подвергается гидролизу, что приводит к образованию пуринового основания гипоксантина и D-рибозы. Гипоксан-тин окисляется до ксантина и далее до мочевой кислоты под действием ксантиноксидазы, сложного флавинзави-симого фермента, в простетической группе которого содержится один атом молибдена и четыре железосерных центра ( разд. [26]
ГДГ, присоединяясь к ней в участках, разобщенных от тех участков, в которых происходит связывание нуклеотидов. Эффект лейцина преодолевает ингибирующее действие аденилатов и таким образом обеспечивает усиленное расщепление аминокислот, ускоряя удаление их азота, как только они начинают накапливаться. Это будет происходить даже в том случае, если во время накопления аминокислот общая потребность в высокоэнергетических фосфатах ( а следовательно, и в катаболизме аминокислот) не очень велика. [27]
А), состоящий из 200 нуклеотидов. Присоединение осуществляется с помощью поли ( аденилат) - полимеразы. Затем мРНК связывается с белком информофером и транспортируется в цитоплазму к рибосомам. [28]
Фракционированием освобожденного от клеток экстракта Bacillus breuis выделена синтетаза грамицидина С, состоящая из легкой и тяжелой фракций ферментной системы. Легкий фермент специфически активирует L-фенилаланин, получается соответствующий аденилат с переносом аминокислоты на тиольную группировку молекулы фермента, хиральный а-центр которой имеет D-конфигурацию. Хотя этот механизм не выяснен до конца, известна его независимость от коферментов и он, возможно, катализируется основаниями. [29]
Фосфорамид далее реагирует с 5 -фосфорильной группой поврежденной ДНК, образуя пирофосфат, который в свою очередь расщепляется при участии З - гидроксильной группы дезоксирибонуклеозида на другой стороне повреждения с завершением образования межнук-леотидной связи и высвобождением AMP. Это пока что единственный обнаруженный случай, когда NAD выступает в роли кофактора переноса аденилата предпочтительнее, чем в более обычном для него качестве окислительно-восстановительного ко-фермента. [30]
Страницы: 1 2 3