А-гликоль
Cтраница 2
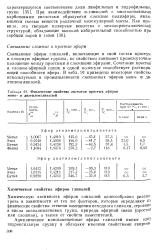 |
Физические свойства ацетатов простых эфиров моно - и диэтиленгликолей. [16] |
При взаимодействии а-гликолей с многоосновными карбоновыми кислотами образуются сложные полиэфиры, являющиеся смесью веществ различной молекулярной массы. [17]
Молекулярные перегруппировки а-гликолей представляют самостоятельный интерес; механизм их превращения иной, а следовательно, некоторые закономерности могут быть характерными только для этих перегруппировок. [18]
Молекулярные перегруппировки а-гликолей представляют само-гоятельный интерес; механизм их превращения иной, а следователь о, некоторые закономерности могут быть характерными только для тих перегруппировок. [19]
В случае двувторичных а-гликолей и пинаконов, у которых оба гидро-ксилированных атома углерода одинаково гидрогенизированы или вовсе не гидрогенизированы, кислотные остатки при образовании оксо-ниевых соединений будут присоединяться к тому или другому из водных остатков в зависимости от характера радикалов, стоящих у гидрокси-лированных углеродных атомов. [20]
Соотношение между а-гликолями и образующимися из них альдегидами и кетонами изучено настолько полно, что во многих случаях по строению последних можно с уверенностью судить о строении исходных а-гликолей. [21]
Для превращения моногалоидгидринов а-гликолей и зс-оки-сей Тиффено также различает гидробензоиновую, семигидробен-зоиновую и семипинаколиновую перегруппировки. [22]
При исследовании дегидратации а-гликолей, изомеризации а-окисей и альдегидо-кетонпой перегруппировки было установлено, что количества альдегидов и каждого из образовавшихся кетонов резко меняются в зависимости от условий реакции. Это позволило предположить возможность изомеризации не только альдегида в кетопы, по и одного кетона в другой. [23]
При разложении ксантогенатов а-гликолей образуются ацетилены. [24]
Специфическим методом окисления а-гликолей до карбонильных соединений является окисление с помощью йодной кислоты. [25]
Хотя при получении а-гликолей условия реакции могут быть весьма различными, производить работу при температурах, превышающих 50, нежелательно, так как это приводит к значительным потерям активного кислорода. Прежде исследователи не были заинтересованы в эффективном использовании активного кислорода и поэтому проводили работу при высоких температурах и были принуждены применять большой избыток пере киси водорода или надкислоты. При температуре ниже 5 - 1ГР реакция протекает очень медлеццо. [26]
Окиси, отвечающие а-гликолям, способны к самостоятельному существованию; соединяясь с водой или кислотами, они дают гликоли и неполные эфиры гликолей. Для того чтобы стало возможным принять окиси как промежуточные вещества при превращении а-гликолей в альдегиды и кетоны, Красуский допускает присоединение к ним элементов кислоты не в обычном порядке, а с образованием хлорноватистых эфиров при хлористом водороде и эфиров надсерной кислоты при кислоте серной, которые и разлагаются затем на кислоту и альдегид или кетон. [27]
Глицериновый альдегид, как а-гликоль, отщепляет воду и дает ме-тилглиоксаль. [28]
Приведенные ниже методы получения а-гликолей указаны в порядке уменьшения их эффективности и желательности применения в качестве лабораторных методов. [29]
Для объяснения механизма перегруппировки а-гликолей в конце прошлого и начале нынешнего столетия неоднократно высказывалась гипотеза об образовании циклических соединений в качестве промежуточных продуктов. [30]
Страницы: 1 2 3 4