Адсорб-тиво
Cтраница 2
Уравнение ( 10) очень хорошо описывает экспериментальный материал с одними и теми же значениями параметров как ниже, так и выше критической точки адсорб-тива. [16]
При неспецкфической адсорбции эта химическая полярность отсутствует. Химическое сродство между адсорбентом и адсорб-тивом часто трудно распознать; поглощение посторонних веществ, например газов или паров, на адсорбентах с большой поверхностью происходит таким образом, что вначале имеет место неполное заполнение, но постепенно плотность адсорбата возрастает и наконец образуется более или менее законченная мономолекулярная поверхностная пленка. По общепринятым представлениям такие дефекты решетки ( Френкель, Шоттки), как углы и края, в адсорбенте представляют собой места наиболее ярко выраженной связи. В этих местах начинает происходить адсорбция за счет остаточных валентностей. Если поглощение вещества продолжать при повышении его концентрации или понижении температуры, то образуются последующие слои адсорбата. В случае хорошо адсорбирующегося вещества, представляющего собой пары легко конденсирующейся жидкости, адсорбционная связь может перейти в так называемую капиллярную конденсацию: при дальнейшем поглощении и повышающемся давлении насыщенного пара имеет место постепенное заполнение пор адсорбента ожиженным паром как в узких, так и в широких порах. Очевидно, что при образовании мономолекулярной пленки адсорбционная способность для данной поверхности адсорбента определяется размерами адсорбируемой молекулы, в то время как при капиллярной конденсации поглотительная способность адсорбента ( адсорбционная емкость) ограничивается объемом молекул адсорбируемого вещества. Следует добавить, что при таком виде адсорбции не имеет места ориентировка вещества на внешней или внутренней поверхности адсорбента, причем проявляется межмолекулярное взаимодействие также и между молекулами адсорбата. [17]
Наличие эффекта послойной отработки подтверждается [7] в специальных опытах и путем численных расчетов, нестационарных полей концентрации внутри адсорбентов, обладающих резко выпуклой изотермой адсорбции. Существенно, что сопротивлением процессу переноса целевого компонента от внешней поверхности частицы к фронту адсорбции здесь служит диффузионное сопротивление полностью насыщенного адсорб-тивом слоя адсорбента; кроме того, значение коэффициента эффективной диффузии О э в пределах равномерно насыщенного слоя изотропного адсорбента может быть только постоянным и не может включать в себя эффект поверхностной диффузии. [18]
Известно, что в зависимости от условий проведения процесса адсорбции в неподвижном слое ( скорость газоносителя, вид и размер зерен адсорбента, концентрация адсорб-тива и др.) определяющей стадией может быть либо внешний мас-сообмен, либо внутренний массоперенос, либо скорость процесса лимитируется одновременно той и другой стадией. В большинстве случаев адсорбции в неподвижном слое на различных участках по длине работающего слоя процесс массообмена лимитируется одновременно внешней и внутренней диффузией, причем соотношение внешне - и внутридиффузионного сопротивлений, как будет показано ниже, изменяется по длине адсорбционной зоны. [19]
Физическая адсорбция протекает самопроизвольно. Адсорбтив стремится целиком занять всю поверхность адсорбента, но этому препятствует процесс противоположный адсорбции - десорбция, вызванный как и диффузия, стремлением к равномерному распределению вещества вследствие теплового движения. Для каждой концентрации адсорб-тива в окружающей среде существует состояние адсорбционного равновесия, аналогичного равновесию между конденсацией и испарением. Понятно, что чем выше концентрация адсорбтива, тем больше адсорбция. Для каждой температуры существует свое состояние равновесия. Влияние температуры на адсорбцию вполне согласуется с принципами ле Шателье - Брауна, поскольку десорбция, как процесс, обратный адсорбции, сопровождается поглощением тепла. Чтобы определить количество адсорбированного вещества, необходимо экспериментально найти, чему равно давление газа или концентрацию адсорбтива в сосуде, в котором происходит адсорбция, до адсорбции и после нее. Адсорбцию очень часто определяют также по привесу адсорбента. [20]
Молекула С находится внутри, молекула D-на поверхности раздела жидкость - газ АВ. На границе раздела фаз появляется избыточная свободная энергия, величина которой измеряется поверхностным натяжением ст. Благодаря этой избыточной поверхностной энергии вещество адсорбирует на своей поверхности другое вещество, которое способно снизить эту поверхностную энергию и соответственно поверхностное натяжение на границе раздела фаз. При этом вещество, на котором происходит адсорбция, называется адсорбентом, а вещество, которое адсорбируется, называется адсорб-тивом. [21]
Этот адсорбент получен из поливинилиденхлорида активацией при 973 К. Адсорбция измерялась в интервале давлений 0 1 - 2 107 Па и температур 120 - 600 К, включавшем критическую точку адсорб-тива ( Гкр 190 8 К) Как и при адсорбции газов на цеолитах, изостеры абсолютной адсорбции метана на ПАУ-10 в широких интервалах температур и давлений хорошо аппроксимируются прямыми линиями. [22]
Адсорбированные молекулы, совершая колебательные движения, могут отрываться от поверхности адсорбента и переходить в другую фазу. Такой процесс называют десорбцией. По мере протекания процесса, скорость адсорбции уменьшается, а скорость десорбции растет, пока эти скорости не уравняются между собой. С этого момента в системе устанавливается динамическое равновесие между молекулами адсорб-тива, находящимися на поверхности и в объеме; такое равновесие называется адсорбционным равновесием. Концентрация ад-сорбтива в объеме или соответствующее ей давление, отвечающее состоянию равновесия, называется равновесной концентрацией или, соответственно, равновесным давлением. [23]
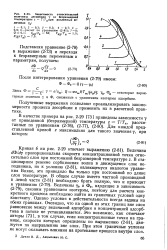 |
Зависимость относительной величины десорбции v от безразмерной температуры z Т / Ткпри различных ве. [24] |
Величина пропорциональна скорости концентрационной точки относительно слоя при постоянной безразмерной температуре г. В стационарном режиме сорбционная волна в движущемся слое неподвижна, но к условию ( 2 - 81), являющемуся аналогом уравнения Викке, это приводило бы только при постоянной по длине слоя температуре. Величины у0 и Ф0, входящие в зависимость ( 2 - 79), связаны уравнением изотермы, поэтому для расчета конкретного процесса необходимо найти из граничных условий одну константу. Однако условия в действительности всегда заданы на обеих границах. Очевидно, что на одной из этих границ вне слоя равновесие между величиной адсорбции и концентрацией адсорб-тива в потоке не устанавливается. Это возможно, как отмечают авторы [73], в том случае, если концентрационные точки на границе, скорости которых определены по выражению ( 2 - 81), движутся по направлению вне слоя. При этом граничные условия не могут оказывать влияния на протекание процесса внутри слоя. [25]
Молекула С находится внутри, молекула D-на поверхности раздела жидкость - газ АВ. На границе раздела фаз появляется избыточная свободная энергия, величина которой измеряется поверхностным натяжением а. Благодаря этой избыточной поверхностной энергии вещество адсорбирует на своей поверхности другое вещество, которое способно снизить эту поверхностную энергию и соответственно поверхностное натяжение на границе раздела фаз. При этом вещество, на котором происходит адсорбция, называется адсорбентом, а вещество, которое адсорбируется, называется адсорб-тивом. [26]
Страницы: 1 2