Адсорбируемость - катион
Cтраница 2
Для катионов одинаковой валентности адсорбционное сродство увеличивается с уменьшением радиуса гидратированного иона [13,21] или, что то же самое, с усилением основных свойств. Таким образом, для солей с обычными анионами чем круче идут соответствующие кривые, тем больше а и тем слабее, следовательно, адсорбируемость катиона ионитами. [16]
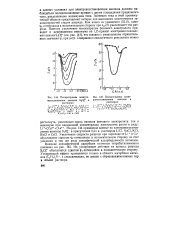 |
Полярограммы электро - [ IMAGE ] Полярограммы элект-влггтянгтлрния яыилнпп. S - П. н оовосстановления анионов в. [17] |
Увеличение скорости разряда при переходе от Li кСз обусловлено сдвигом о - потенциала в положительную сторону за счет усиления в том же ряду специфической адсорбируемости катионов. Их ускоряющее действие на процесс разряда S2OJ - объясняется сдвигом - потенциала в положительную сторону. Ускоряющий эффект проявляется только в области адсорбции катионов ( C4H9) 4N, а следовательно, не связан с образованием ионных пар в объеме раствора. [18]
Если главным фактором в механизме поглощения катионов окисленным углем является прочность координационных связей сорбированных ионов с поверхностными кислородсодержащими группами, то должен, очевидно, существовать определенный параллелизм между рядом адсорбируемости катионов и рядами констант устойчивости указанных выше комплексных соединений тех же металлов в растворах. Такой параллелизм действительно наблюдается. [19]
Большое практическое значение имеет адсорбция электролитов из их водных растворов твердыми адсорбентами. Здесь мы встречаемся с такой особенностью: адсорбируемость катионов и анионов данного электролита, как правило, неодинакова. Это зависит от химической природы иона, его валентности ( размера заряда) и гидратируемости, а также от растворимости адсорбционного комплекса, образуемого ионом с адсорбентом. [20]
Слабые электролиты, диссоциирующие в растворе лишь в малой степени, как например жирные кислоты, в большинстве случаев адсорбируются твердой фазой целыми молекулами. Иначе протекает адсорбция сильных электролитов, находящихся в растворе в диссоциированном состоянии. Дело в том, что адсорбируемость катионов и анионов данного электролита, как правило, неодинакова. Для каждого рода ионов существует своя особая изотерма адсорбции Г, с, отличная от других. В связи с этим в системе могут возникнуть процессы, стремящиеся максимально снизить эту разность потенциалов и противодействующие адсорбции ионов данного знака. Таким образом, адсорбция ионов сильных электролитов протекает под воздействием сил двух родов: а) молекулярно поверхностных сил адсорбента, как и у всех видов адсорбционных процессов вообще, и б) сил электрических, проявляющихся только в случаях адсорбции ионов. [21]
Данные табл. 3 свидетельствуют о заметной зависимости параметров плотного слоя от природы адсорбирующегося иона и растворителя. Значения / Со2 в пределах данного растворителя почти не зависят от природы иона и близки к интегральной емкости Кг в условиях отсутствия специфической адсорбции ионов. Величины К 2 сильно уменьшаются с возрастанием адсорбируемости катиона как в данном растворителе, так и при переходе от одного растворителя к другому. [22]
Страницы: 1 2