Адсорбция - ион - водород
Cтраница 2
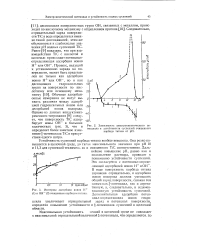 |
Зависимость электрокинетического потенциала и устойчивости суспензий очищенного карбида титана от рН. [16] |
Устойчивость суспензий карбида титана вообще невысока. Она резко повышается в щелочной среде, ДО тигая максимального значения при рН 10 и 11 3 для суспензий техничес го и очищенного TiC соответственно. Дальнейшее повышение рН, равно как и подкисление раствора, приводит к понижению устойчивости суспензий. В воде поверхность карбида титана заряжена отрицательно, и адсорбция ионов водорода должна уменьшать общий заряд поверхности, снижая тем самым как - потенциал, так и агрега-тивную, а, следовательно, и седимен-тационную устойчивость суспензий. Дополнительная адсорбция потенциал-определяющих ионов гидро-ксила увеличивает отрицательный заряд и потенциал поверхности, определяя повышение устойчивости и - потенциала суспензий в щелочной области. [17]
 |
Кювета для проведения диализа. [18] |
Коагуляция золя может быть осуществлена также путем нейтрализации адсорбированных ионов, которые создают дзета-потенциал. Раствор Na2SO4 действует на золь из оксида железа приблизительно в 50 раз эффективнее эквимоляр-ного количества раствора NaCl, а раствор K4Fe ( CN) 6-почти в 100 раз эффективнее его. По-видимому, анионы, содержащиеся в растворе соли, противодействуют адсорбции ионов водорода на коллоидных частицах, причем, чем выше заряд анионов, тем более эффективно они снижают дзета-потенциал до точки коагуляции. [19]
Оказалось, что адсорбция воздуха ведет к значительному обратимому уменьшению люминесценции. При этом влажный воздух в отношении гасящего действия оказывается более эффективным. Гашение инфракрасной люминесценции закиси меди при контакте с водой и некоторыми электролитами, наблюдавшееся в работе [43], связывается с адсорбцией ионов водорода, которые выступают в этом случае в роли акцепторов электронов. [20]
Для более основных оксидов наблюдается увеличение положительного заряда на поверхности с ростом кислотности среды. Гидр-оксильные группы уходят с поверхности и в растворе нейтрализуются ионами водорода. Например, золь оксида железа более устойчив в кислой среде, в которой частицы имеют положительный заряд. Менее основные оксиды, такие, как кремнезем, приобретают в кислой среде положительный заряд ( ниже изоэлектрической точки) в результате адсорбции ионов водорода на гидроксильных группах поверхности. [21]
Он измерял электропроводность различных порошкообразных крекингкатализаторов и нашел, что изменение электропроводности с температурой обнаруживает разрыв непрерывности при температуре, которая является характерной для окислов. Патрик считает, что кремнезем в алюмосиликатном катализаторе в электрическом поле становится отрицательно заряженным благодаря диссоциации ионов водорода из силанольных групп поверхности, а глинозем - положительно заряженным вследствие адсорбции ионов водорода на его поверхности. Изменение наклона кривой электропроводность - температура в случае алюмокремниевых гелей происходило при наиболее низкой температуре, что приписывают меньшему количеству энергии, которая требуется для диссоциации водорода из SiOH-группы в присутствии групп АЮН, являющихся акцепторами диссоциированного протона. [22]
Выделение водорода - очень сложная реакция, состоящая и нескольких ступеней. Каждая ступень имеет несколько стадий, так что данная достаточно хорошо изученная реакция на самом деле подобна длинноцепной реакции. Далее, скорость этого процесса не всегда определяется только одной стадией. Примеси могут либо увеличить, либо уменьшить скорость выделения водорода, так как создаваемые ими различия поверхности будут воздействовать на одну или несколько стадий реакции. Не всегда ясно, будет ли это влияние сказываться на первоначальной адсорбции ионов водорода на поверхности металла, образовании атомов водорода, мобильности протонов или отделении молекул, и маловероятно, что примеси воздействуют только на какую-либо одну из перечисленных ступеней. Так, например, мышьяк и сера, по-видимому, замедляют реакцию соединения двух атомов в соответствии с уравнением ( 21) и, следовательно, повышают вероятность растворения водорода в металле, В частности, для черных металлов наводороживание и пузырение часто вызываются средами, содержащими соединения этих веществ. [23]
Давно замечено, что найлон, так же как и белковые волокна, может быть окрашен кислотными красителями из кислого раствора. Это открытие было довольно неожиданным, поскольку считали, что в найлоне нет основных групп, которые могли бы образовывать участки, способные адсорбировать такие кра - сители. Однако работа Питерса 117 ] ясно показала, что крашение происходит за счет групп основного характера, которые остаются на концах полимерных цепей. Лемин [ 31, измеряя адсорбцию соляной кислоты найлоном при различных значениях рН, обнаружил перегиб на кривой, который не был замечен прежними исследователями и который он связал с адсорбцией за счет концевых аминогрупп. Было высказано предположение, что значительная адсорбция кислоты при низких значениях рН объясняется присоединением к амидным группам. Это предположение подтверждается тем, что в суспензиях найлона и дибензилдикетопиперазина частички приобретают положительный заряд при значениях рН ниже 2 7, что должно соответствовать адсорбции ионов водорода на амидных группах. Точка зрения Ремингтона и Глэддинга [18] по этому вопросу будет рассмотрена далее. Количество кислоты, поглощенной в точке перегиба, составляет примерно 0 035 эквивалента на 1 кг волокна, что хорошо согласуется с данными о содержании свободных концевых аминогрупп, определенных титрованием найлона в растворителе. На основании полученных данных был сделан вывод о том, что при рН выше 8 найлон адсорбирует эти кислотные красители в незначительном количестве. С понижением рН начинается взаимодействие ионов с положительно заряженными аминогруппами, продолжающееся до насыщения всех групп. Дальнейшее понижение рН не может вызвать дополнительную адсорбцию до тех пор, пока рН не достигнет значения 3, при котором амидные группы начинают реагировать снопами водорода, становясь тем самым как бы заряженными центрами для дальнейшей адсорбции красителя. Эта теория была подтверждена опытами по ацетилированию волокна, которыми было показано, что адсорбция красителя на обработанном таким обр азом волокне понижается на одинаковую величину при всех значениях рН вследствие блокирования аминогрупп. [24]
Активированные окись алюминия и Дуциль, оба щелочные по природе, являются неактивными катализаторами скелетной изомеризации олефинов. Обработанная кислотой окись алюминия являлась уже кислой по характеру и оставалась таковой после употребления ее в качестве катализатора скелетной изомеризации при 335 С. Силикагель и уголь, не являющиеся активными катализаторами скелетной изомеризации олефинов, не активируются даже и после их обработки кислотой, в противоположность окиси алюминия. Обнаружено также, что эти катализаторы не могут адсорбировать селективно ионов водорода, остающихся после сушки. На основании этих наблюдений можно предположить, что изомеризация олефинов происходит благодаря адсорбции ионов водорода, вызывающей взаимодействие между катализатором и углеродными атомами двойной связи, и что это взаимодействие частично включает атом или ион водорода, источником которого является катализатор. [25]
Страницы: 1 2