Адсорбция - муравьиная кислота
Cтраница 2
Исследователи датской школы в своих рассуждениях основываются на том, что инфракрасная спектроскопия определенно доказывает, что при адсорбции муравьиной кислоты на поверхности катализатора образуется соль муравьиной кислоты ( см. разд. Важнейшим моментом в их объяснении катализа является допущение, что на всех металлах разложение проходит через стадию образования промежуточной формы - соли муравьиной кислоты ( см. также разд. Последняя фактически представляет энтальпию образования формиа-та данного металла. [16]
Изменение условий тренировки образцов окиси иттрия и модифицирование поверхности хемосорбирован-ными примесями, сильно влияющие на скорость и величину адсорбции муравьиной кислоты, сказываются и на реакционной способности и селективности разложения адсорбированной кислоты. [17]
 |
Инфракрасные спектры несвязанных ОН-групп на поверхности Т1О. [18] |
Подобные результаты были получены и для образцов окиси хрома, однако не удалось добиться достаточной степени пропускания в области, соответствующей изолированным ОН-группам. После адсорбции муравьиной кислоты до 6 1 и последующего откачивания катализаторов при комнатной температуре для обоих окислов появляется полоса при 1430 см-1, а интенсивность полос 1580 и 1365 см-1 уменьшается. Новая полоса, соответствующая поверхностным группам С0з -, исчезает при слабом нагревании или при повторной обработке парами муравьиной кислоты. [19]
Интерпретация данных, полученных из инфракрасных спектров, в дальнейшем была подтверждена калориметрическими измерениями. Так, например, теплота адсорбции муравьиной кислоты при монослойном заполнении составляла 18 ккал / моль, что вполне удовлетворительно согласуется с теплотой образования / 2 моля № ( ООСН) 2, равной 13 ккал. [20]
По ходу кривых легко заметить, что скорость уменьшения поверхностного натяжения в растворе муравьиной кислоты наименьшая, а в растворе валериановой кислоты наибольшая. Это указывает на то, что адсорбция муравьиной кислоты при повышении концентрации растет незначительно, тогда как адсорбция валериановой кислоты быстро нарастает с увеличением концентрации. [21]
Все потенциалы даны относительно водородного электрода в том же растворе, все токи и скорости отнесены к единице истинной поверхности электрода. Следует отметить, что измерения окисления и адсорбции муравьиной кислоты в растворах с рН 8 очень трудно проводить из-за нестабильности токов, быстрого отравления электрода какими-то неокисляющимися частицами, образующимися при каталитическом разложении муравьиной кислоты при контакте раствора с платиной. В кислых растворах при достаточно высокой концентрации муравьиной кислоты ( больше 0 5 М) этот процесс также наблюдается, но идет с очень малой скоростью и приводит лишь к некоторым искажениям зависимостей в этих растворах. [22]
Это предположение подтверждается также измерениями адсорбции муравьиной кислоты. Поэтому не должно быть каких-либо затруднений при адсорбции муравьиной кислоты по сравнению с адсорбцией водорода. [23]
 |
Изменение сопротивления прозрачной никелевой пленки при адсорбции окиси углерода при комнатной температуре. [24] |
В соответствии с предшествующими исследованиями [2] были приняты все меры предосторожности, связанные с применением новейшей вакуумной аппаратуры для испарения пленки, получения паров муравьиной кислоты и изучения их влияния. На рис. 5 показано изменение сопротивления пленки, охлажденной до 90 К [3], при адсорбции муравьиной кислоты. Это соответствует переходу электрона от молекулы муравьиной кислоты к поверхности никеля. При 90 К разложение не происходит, так как наблюдается только спонтанное уменьшение сопротивления. [25]
В присутствии небольших количеств олеиновой кислоты адсорбция муравьиной практически не изменилась. Однако по мере увс личения концентрации олеиновой кислоты в тройной смеси имеет место некоторое снижение величины адсорбции муравьиной кислоты. [26]
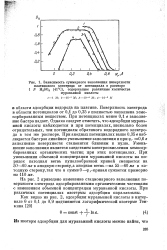 |
Зависимость суммарного заполнения поверхности. [27] |
Поверхность электрода в области потенциалов от 0 1 до 0 35 в полностью заполнена хемо-сорбированным веществом. При потенциалах менее 0 1 в заполнение быстро падает. Однако следует отметить, что адсорбция муравьиной кислоты наблюдается и при потенциалах, несколько более отрицательных, чем потенциалы обратимого водородного электрода в том же растворе. При анодных потенциалах выше 0 35 в наблюдается быстрое линейное уменьшение заполнения и при срг 0 6 в заполнение поверхности становится близким к нулю. Уменьшение заполнения является следствием электроокисления хемосор-бированных органических частиц при этих потенциалах. При уменьшении объемной концентрации муравьиной кислоты на порядок катодная ветвь куполообразной кривой смещается на 50 - 60 мв в анодную сторону а анодная ветвь-на 55 - 60 мв в катодную сторону так что в сумме 0 - ф г-кривая сужается примерно на 110 мв. [28]
Для различных объемных концентраций кинетические изотермы адсорбции практически параллельны. Заметное отклонение от закономерности ( 5) наблюдается только в 10 М растворе НСООН при 6 0 5, что, вероятно, связано с побочными каталитическими процессами. С уменьшением объемной концентрации скорость адсорбции муравьиной кислоты быстро падает. [29]
Страницы: 1 2