Адсорбция - метан
Cтраница 1
Адсорбция метана и этана не приводит к сжатию, в случае же этилена и ацетилена сжатие имеет место. [1]
Для адсорбции метана значение р, полученное при использовании определенных при высоких температурах опытных значений К1 [44] близко к значению р, полученному для этана и пропана. Это расхождение может быть вызвано квантовостатц-стическими эффектами, проявляющимися при более низких температурах. [2]
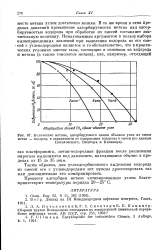 |
Количество метана, адсорбируемого одним объемом угля из смеси метан - водород, в зависимости от содержания водорода в смеси ( по данным Потоловского, Спектора и Каминера. [3] |
Процессу адсорбции метана активированным углем благоприятствуют температуры порядка 20 - 25 С. [4]
Термодинамические характеристики адсорбции метана этана и пропана на базисной грани графита, полученные при использовании приближенных атом-атомных потенциальных функций. [5]
Ясно, что прочность адсорбции метана по сравнению с прочностью адсорбции дейтерия зависит от металла и увеличивается от никеля к палладию. Относительное количество CHD3 по сравнению с CD4 также увеличивается от никеля к палладию, чего и следует ожидать, если возможен переход водорода между адсорбированными радикалами. [6]
В работах [81, 162] кинетика адсорбции метана, этана, пропана и к-бутана на цеолите СаА изучена весовым методом. Согласно полученным данным, скорость диффузии и кажущаяся энергия активации зависят от концентрации. Более удовлетворительные корреляции получены после введения коэффициента сопротивления. Коэффициент сопротивления является эмпирической величиной, которая служит мерой общего сопротивления структуры цеолита потоку адсорбата. [7]
На рис. 128 приведены изотермы адсорбции метана, этана и пропана таким углем, на рис. 129 - изотермы адсорбции этилена. Как видно из рисунков, метан и этан адсорбируются слабее этилена; пропан до 120 С адсорбируется сильнее, чем этилен, при более высоких температурах-слабее. В работе [3] приводятся данные по адсорбционному равновесию для восьми низших углеводородов от метана до 4, на силикагеле и некоторых активированных углях при давлениях до 1 атм и температуре 25 С. [8]
На рис. 6а представлены изотермы адсорбции метана и водорода при адсорбции их из бинарной смеси. Однако сравнение точек изотермы чистого метана ( пунктирная кривая) и изотермы метана в присутствии водорода при равном парциальном давлении показывает, что присутствие водорода значительно снижает адсорбционную-способность. Адсорбционная способность в присутствии водорода составляет лишь 43 - 52 % от сорбционной способности. [9]
На рис. 66 показаны изотермы адсорбции метана в присутствии водорода на угле АГ-2. Оныты с разными концентрациями указывают, что чем выше разбавление водородом, тем больше относительное отклонение изотермы, полученной на смеси водород-метан от изотермы чистого метана. [10]
Для суждения об этом необходимо уточнение опытных данных для адсорбции метана в широком интервале температур. [11]
Полученные в работе [38] значения теплот и энергий активации адсорбции метана и его хлорпроизводных позволили автору предполагать слабую хемосорбцию их на поверхности угля, каолина и каталитическое участие этих контактов в процессе хлорирования. [12]
Этот метод, разработанный для хемосорб-ции одного компонента, применялся к адсорбции метана, пропана, этилена и пропилена на активированном угле. Оказалось, что только адсорбция метана описывается уравнением Лэнгмюра. Для других газов было применено общее уравнение адсорбции. [13]
В работе угледобывающих предприятий большое практическое значение имеет способность углей к адсорбции метана и других газов. [14]
На у - А12О3 в отличие от всех других окислов наблюдается обильная темновая адсорбция метана. Действие света приводит к повышению давления в системе, которое имеет, по-видимому, чисто тепловой характер. [15]
Страницы: 1 2 3 4