Адсорбция - молекула - растворитель
Cтраница 1
Адсорбция молекул растворителя проявляется в их ориентации и упорядоченном расположении вдоль поверхности раздела. Так как в индивидуальном растворителе практически вся поверхность покрыта ими, то адсорбция других компонентов возможна только при десорбции части молекул растворителя. [1]
Другой фактор, который мог быть упущен - это адсорбция молекул растворителя. [2]
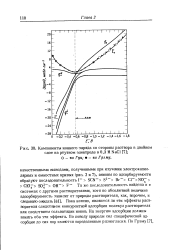 |
Компоненты ионного заряда со стороны раствора в двойном. [3] |
Пока неясно, являются ли эти эффекты растворителя следствием конкурентной адсорбции молекул растворителя или следствием сольватации ионоа На энергию адсорбции должны влиять оба эти эффекта. По поводу природы сил специфической адсорбции до сих пор имеются определенные разногласия. [4]
С позиций сольватной теории лучше всего объясняются начальные стадии растворения, главная из которых - адсорбция молекул растворителя на поверхности вещества. Адсорбированные молекулы вступают во взаимодействие с поверхностью кристалла, образуя непрочные соединения - сольваты, диффундирующие в раствор. [5]
Клебер [46, 47] сравнил уменьшение удельной свободной энергии поверхности / - - граней и / ( - граней, обусловленное адсорбцией молекул растворителя. Наибольшие изменения габитуса происходят при этой максимальной разности. Если уменьшение поверхностной свободной энергии одинаково для обоих типов граней, габитус почти не изменяется. [6]
Кроме того, при электроосаждении металлов из органических растворителей следует считаться е весьма большой вероятностью пассивации поверхности электрода вследствие нн-гибирующен адсорбции молекул растворителя лн продуктов его вос-стаковлегня. [7]
 |
Дифферзнциальная кривая ГД6 А - величина адсорбции на изменения размсрэв поверхности единицу поверхности адсорбента. пор в зависимости от их радиуса. S - удельная поверхность единицы. [8] |
В случае адсорбции растворенных веществ вопрос осложняется присутствием растворителя благодаря тому, что, наряду с адсорбцией молекул растворенного вещества, происходит одновременно адсорбция молекул растворителя. [9]
При этом наличие растворителя между молекулами полимера может приводить не только к уменьшению энергетического барьера из-за понижения вязкости системы и экранирования полярных групп макромолекул, но-и к увеличению энергетического барьера в результате своеобразной адсорбции молекул растворителя на макромолекулах, что, конечно, препятствует свободе вращения вокруг связи С-С. Короче говоря, следует помнить, что при растворении в зависимости от условий цепи полимера могут становиться как более гибкими, так и более жесткими. [10]
При этом наличие растворителя между молекулами полимера может приводить не только к уменьшению энергетического барьера из-за понижения вязкости системы и экранирования полярных групп макромолекул, но и к увеличению энергетического барьера в результате своеобразной адсорбции молекул растворителя на макромолекулах, что, конечно, препятствует свободе вращения вокруг связи С-С. Короче говоря, следует помнить, что при растворении в зависимости от условий цепи полимера могут становиться как более гибкими, так и более жесткими. [11]
Существенное отличие адсорбции из растворов от адсорбции из газовой фазы состоит в том, что адсорбция из раствора представляет не простую адсорбцию, обусловленную взаимодействием только поверхности твердого вещества и молекул растворенного вещества, а адсорбцию, которая осложнена одновременно происходящей на поверхности того же твердого тела адсорбцией молекул растворителя. Адсорбция из растворов является результатом конкуренции за центры адсорбции на поверхности молекул растворенного вещества, с одной стороны, и молекул растворителя - с другой. [12]
Эта энергия зависит от строения молекул растворенного вещества и их концентрации. При адсорбции молекулы растворителя также преодолевается полностью или частично энергия связи этой молекулы с другими молекулами растворителя, обусловленная структурой жидкости. Сама прочность структуры воды на границе с гидрофильной или гидрофобной поверхностью адсорбента должна существенно различаться. [13]
Эта энергия зависит от строения молекул растворенного вещества и их концентрации. При адсорбции молекулы растворителя также преодолевается полностью или частично энергия связи этой молекулы с другими молекулами растт ворителя, обусловленная структурой жидкости. Сама прочность структуры воды на границе с гидрофильной или гидрофобной поверхностью адсорбента должна существенно различаться. [14]
При изучении каталитических реакций в растворе часто не учитывается физическая адсорбция молекул растворителя. У нас создалось впечатление, что во многих опытах Мэкстеда [52] по изучению отравления катализаторов адсорбция молекул растворителя играет более важную роль, чем предполагает сам автор работы. Имеются основания думать, что критическое изучение адсорбции молекул растворителя и их влияние на адсорбцию молекул яда может привести к еще более важным выводам относительно явления отравления, чем те, которые уже были получены Мэкстедом и его сотрудниками в их систематических и обстоятельных исследованиях. [15]
Страницы: 1 2