Адсорбция - дифильная молекула
Cтраница 1
 |
Схема, иллюстрирующая ори - Возду. [1] |
Адсорбция дифильных молекул, вероятно, сказывается различным образом на зависимости энергии пленки от ее толщины / г. При больших толщинах диполь-дипольное взаимодействие молекул должно приводить к увеличению глубины вторичного-минимума t / 2 mm - При малых значениях / г, сравнимых с удвоенным размером молекул ПАВ, следует ожидать противоположного влияния адсорбционных слоев на утончение пленки, поскольку последнее связано с необходимостью переориентации диполей на одной из границ раздела фаз. Возможность заметного изменения молекулярной компоненты расклинивающего давления при адсорбции ПА В на межфазных поверхностях подтверждается результатами расчетов, выполненных уже сравнительно давно [551] в соответствии с микроскопической теорией молекулярного взаимодействия конденсированных сред и, более строго, в работе [550] на основе макроскопической теории. Такие изменения особенно значительны при значениях h порядка нескольких нанометров. [2]
Поэтому при адсорбции дифильных молекул неионогенных ПАВ на углеродной поверхности конкуренция алкильных и оксиэтильных цепей должна быть определяющим фактором в ориентации адсорбированных молекул на поверхности раздела фаз. В результате полиоксиэтиленовые цепи, связанные эфирным кислородом с прочно адсорбированными алкильными радикалами, десорбируясь под влиянием теплового движения, осциллируют, отклоняясь от поверхности раздела фаз. С увеличением равновесной концентрации раствора плотность заполнения поверхности раздела раствор - углеродная поверхность молекулами ПАВ возрастает, что приводит к постепенному вытеснению оксиэтильных цепей с поверхности углеводородными радикалами молекул. В результате такого вытеснения осциллирующие полиоксиэтиленовые цепи не могут приблизиться к поверхности раздела фаз более, чем на некоторый предельный угол. [3]
Различают два вида адсорбции дифильных молекул. На границах раздела вода - неполярная фаза ( вода - воздух, вода - углеводород) адсорбция имеет, по определению П. А. Ребиндера, пассивный характер, так как происходит путем, выталкив ания углеводородных радикалов из водной фазы вследствие интенсивного взаимного притяжения полярных молекул воды. Носителем поверхностной активности при адсорбции из воды на границе с неполярной фазой служит углеводородный радикал. & этом процессе достигается такой ориентацией молекул ПАВ в адсорбционном слое, при которой гидрофобная часть молекулы в большей или меньшей степени переходит в неполярную фазу, а, полярная группа остается в воде ( йрХм а 5 аента щ) 7 Такая адсорбция является неспецифической, для нее характерно подчинение правилу Дюкло - Траубе. [4]
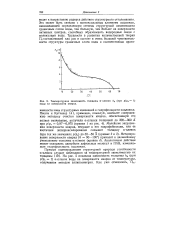 |
Температурная зависимость толщины ос-пленок Л0 ( при plps 1 воды на поверхности кварца. [5] |
Аналогичное действие может оказывать адсорбция дифильных молекул и ПАВ, изменяющая гидрофильность подложки. [6]
Уравнение Шишковского было положено американским физико-химиком Лангмюром в основу его обобщающих работ по адсорбции дифильных молекул на поверхности водный раствор - воздух, опубликованных в 1917 г. Константы а и ft в уравнении Шишковского непосредственно связаны с константами Лангмюра: а - постоянная для всего данного гомологического ряда ( она равна Г RT), b - вторая постоянная из уравнения Лангмюра, обозначаемая той же буквой, что и в уравнении Шишковского. Поверхностная активность вещества, или его способность понижать поверхностное натяжение, также увеличивается при переходе к каждому высшему гомологу в 3 - 3 5 раза. Эта зависимость была установлена и сформулирована как эмпирическое правило Траубе и затем подтверждена опытами Шишковского. [7]
Таким образом, величина срсн отражает термодинамическую невыгодность нахождения СН2 - группы в объеме воды - стремление к выталкиванию из воды углеводородного радикала; именно этот последний и оказывается в рассмотренном случае адсорбции дифильных молекул ПАВ на границе раствор - воздух носителем поверхностной активности. Исследования последнего времени показали, что энергетика адсорбции органических ПАВ из водного раствора, так же как и близких по природе процессов растворения ПАВ и углеводородов в воде, имеет сложную природу, связанную с особенностями структуры воды как растворителя. [8]
При наложении отрицательного потенциала или при интенсивном перемешивании среды необратимая адсорбция ингибитора нами обнаружена лишь на части защищаемой поверхности, а с остальной части металла происходит десорбция относительно слабо связанных с твердой поверхностью молекул, что, по-видимому, обусловлено указанной выше особенностью адсорбции дифильных молекул на поверхности металла. [9]
Таким образом, величина рсн отражает термодинамическую невыгодность нахождения СН2 - группы в объеме воды - стремление к выталкиванию из воды углеводородного радикала. Именно этот последний и оказывается в рассмотренном случае адсорбции дифильных молекул ПАВ на границе раствор - воздух носителем поверхностной активности. Исследования последнего времени показали, что энергетика адсорбции органических ПАВ из водного раствора, так же как и близких по природе процессов растворения ПАВ и углеводородов в воде, имеет сложную природу, связанную с особенностями структуры воды как растворителя. [10]
Поверхностно-активные вещества ( ПАВ) способствуют снижению поверхностного ( межфазного) натяжения вследствие адсорбции и ориентации молекул на поверхности раздела фаз. Они характеризуются незначительной величиной максимально возможной концентрации их в растворе в молекулярной форме, способностью образовывать мицеллы выше определенной, так называемой критической концентрации мицеллообразования ( ККМ), связанной с уменьшением свободной энергии системы, а также солюбизацией водонерастворимых веществ внутри мицелл. Гидрофильные группы способствуют растворению ПАВ в воде, а гидрофобные ( в основном углеводородные) - в неполярных средах. При адсорбции дифильных молекул гидрофильные группы атомов ориентируются в сторону полярной ( например, водной) фазы, а гидрофильные - в сторону неполярной ( углеводородной) фазы. [11]
При адсорбции неионогенных ПАВ ( НПАВ) адсорбционный слой формируется как за счет длинных углеводородных радикалов так и за счет полиоксиэтиленовых цепей соизмеримой длины, являющихся гидрофильной частью дифильных молекул. В отличие от мономерной окиси этилена длинные полиоксизтиленовые цепи Способны избирательно адсорбироваться из водных растворов на углеродных поверхностях. Поэтому при адсорбции дифильных молекул НПАВ конкуренция между ал-кильными и полиоксиэтиленовыми цепями влияет на характер ориентации на поверхности раздела фаз. [12]
При адсорбции неионогенных ПАВ ( НПАВ) адсорбционный слой формируется как за счет длинных углеводородных радикалов, так и за счет полиоксиэтиленовых цепей соизмеримой длины, являющихся гидрофильной частью дифильных молекул. В отличие от мономерной окиси этилена длинные полиоксиэтиленовые цепи способны избирательно адсорбироваться из водных растворов на углеродных поверхностях. Поэтому при адсорбции дифильных молекул НПАВ конкуренция между алкильными и полиоксиэтиленовыми цепями влияет на характер ориентации на поверхности раздела фаз. [13]
Страницы: 1