Адсорбция - окись - углерод
Cтраница 2
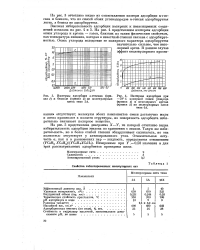 |
Изотермы адсорбции к-гексана ( кри - [ IMAGE ] Изотермы адсорбции при. [16] |
На рис. 4 представлены изотермы адсорбции окиси углерода и аргона - газов, близких по таким физическим свойствам, как температура кипения, которая в известной степени связана с адсорбируе-мостью. [17]
На рис. 2 приведены изотермы адсорбции окиси углерода на активном угле из скорлупы кокосовых орехов [5] в области температур выше критической. [18]
Теория молекулярных орбиталей может описать адсорбцию окиси углерода на неоднородной поверхности с центрами, находящимися на углах, ребрах и плоскости. [19]
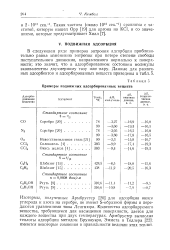 |
Примеры подвижных адсорбированных веществ. [20] |
Изотермы, полученные Армбрустер [20] для адсорбции окиси углерода и азота на серебре, не имеют S-образной формы и передаются уравнениями типа Ленгмюра. Количество адсорбируемого вещества, требующееся для насыщения поверхности, дается для каждого вещества при двух температурах. Армбрустер вычислил теплоты адсорбции методом Брунауэра, Эммета и Теллера [22]; имеются некоторые сомнения в правильности величин этих теплот. [21]
На рис. 15 приведены типичные изотермы адсорбции окиси углерода углем, вычисленные по уравнению изотермы адсорбции Фрейндлиха. [22]
Наконец, следует отметить, что адсорбцию окиси углерода при 77 К уже давно используют для измерения величины поверхности металла в железных катализаторах синтеза аммиака [102-105], принимая Хт. Методика определения предполагает повышение давления окиси углерода до - 60 кПа, в полученные результаты вводится поправка на физическую адсорбцию. [23]
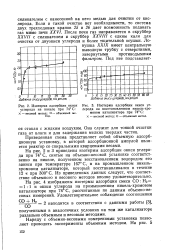 |
Изотерма адсорбции окиси [ IMAGE ] Изотерма адсорбции окиси уг. [24] |
На рис. 2 и 3 приведены изотермы адсорбции окиси углерода при 74 С, снятые на объемно-весовой установке соответственно на никеле, полученном восстановлением водородом его закиси при температуре 167 С, и на промышленном никель-хромовом катализаторе, который восстанавливался в течение 12 ч при 300 С. Из приведенных данных следует, что соответствие объемного и весового методов вполне удовлетворительно. [25]
В табл. 3.3 приведены экспериментальные значения теплот адсорбции окиси углерода, двуокиси углерода и кислорода на поверхностях окислов меди, никеля и кобальта. Буквами а, Ь, с, d, e, / и g обозначены соответствующие типы предварительной обработки поверхности. Если теплоту сгорания окиси углерода ( 67 ккал-молъ-1 при образовании двуокиси углерода) обозначить через h, то теплота адсорбции окиси углерода на поверхности, содержащей предварительно адсорбированный кислород, в случае образования комплекса С03 равна h - ( el2) d, а в случае образования комплекса С02 соответственно равна h - ( е / 2) с. [26]
Бик, Смит и Уилер [18] исследовали адсорбцию окиси углерода, водорода, кислорода, азота и этилена на пленках из железа, никеля, тантала, вольфрама, родия и протактиния. Вообще говоря, результаты этих авторов, а также Трепнела, Кембола и Элея согласуются с данными Лэнгмюра и Робертса, однако ими [18] было сделано важное открытие, что хемосорбция на разных кристаллических плоскостях протекает в различной степени и, кроме того, наблюдаются параллельные различия в каталитической активности. [27]
Значительными особенностями обладают спектры ИК, полученные при адсорбции окиси углерода на цеолитах, модифицированных растворами гидрооксосоединений переходных металлов [ 17 J. В таких цеолитах с помощью рентгенофазового и термогравиметрического анализов, а также электронно-микроскопическим исследованием кристаллов цеолитов фаза гидроокиси или окиси металла н еобнаруживается. В то же время по характеру спектров ЭПР для цеолитов меди [16] и по величине магнитной восприимчивости для цеолитов никеля и кобальта [ 131 можно предполагать, что основная часть введенного элемента находится в цеолитах в ассоциированной форме, для которой характерно сильное обменное взаимодействие между катионами. Характер адсорбционного взаимодействия катионов в сильных ассоциатах с окисью углерода существенно отличается от наблюдаемого для цеолитов с изолированными катионами и цеолитов с фазой окиси металла. Полоса, характерная для адсорбционного взаимодействия СО - СиО и СО - N10, в указанном случае не наблюдается. [28]
Скорником, Штейнбергом и Стоуном [89] определена теплота адсорбции окиси углерода на отравленной поверхности окиси никеля. [29]
Гарнер, Грэй и Стоун [62] нашли, что адсорбция окиси углерода при комнатной температуре приводит к уменьшению проводимости закиси меди. После откачки проводимость быстро восстанавливается до первоначального значения. При нагревании адсорбированной окиси углерода выше 100 С десорбируется углекислый газ и наблюдается неуклонное падение электропроводности в результате удаления избыточных ионов кислорода из решетки. Хотя Гарнер, Стоун и Таили нашли, что только часть адсорбированной окиси углерода быстро удаляется при откачке, Гарнер, Грэй и Стоун наблюдали при откачке быстрое изменение проводимости до начального зна: чения. По нашему мнению, эти результаты показывают, что адсорбция окиси углерода при комнатной температуре протекает двумя различными путями, причем на электропроводность влияет только быстро десорбируемая фракция. [30]
Страницы: 1 2 3 4