Адсорбция - пар
Cтраница 2
При адсорбции паров ( газов) объемная концентрация молекул пара в адсорбционном слое много больше объемной концентрации молекул пара в остальной части парового пространства, и поэтому величину Г ( Р) можно рассматривать как величину поверхностной концентрации адсорбированного вещества. [16]
При адсорбции паров двух или нескольких веществ обнаружено, что адсорбируются все компоненты смеси, причем степень адсорбции каждого компонента ниже, чем адсорбция индивидуального вещества в тех же условиях, а соотношения их концентраций в адсорбенте будут обратно пропорциональны их относительной летучести. [17]
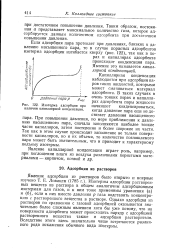 |
Изотерма адсорбции при начинают конденсироваться, наличии капиллярной конденсации. когда давление пара еще не достигает давления насыщенного. [18] |
Если адсорбция пара протекает при давлениях, близких к давлению насыщенного пара, то в случае пористых адсорбентов изотерма адсорбции изгибается кверху ( рис. 122), так как в порах и капиллярах адсорбента происходит конденсация пара. Явление это называется капиллярной конденсацией. [19]
При адсорбции паров адсорбат представляется как сжатая жидкость, однако его плотность не превосходит плотность соответствующей жидкости. [20]
При адсорбции паров метанола на активном угле присутствие воздуха отражается на адсорбционной ветви изотермы и практически не сказывается на десорбционной. Для сорбции метанола на силикагеле введение воздуха практически не влияет на адсорбционную ветвь изотермы, но заметно влияет на десорбционную ветвь, причем с увеличением давления воздуха площадь гистерезисной петли увеличивается. [21]
Для адсорбции паров дихлорэтана из коксового газа был применен активированный уголь марки АР-3, рекомендуемый обычно для рекуперации летучих растворителей и ранее изученный в этом процессе на экспериментальной установке. [22]
При адсорбции паров ацетона в баллоне частицы древесного активного угля линейно расширяются пропорционально понижению поверхностной активности, сопровождающему процесс адсорбции. Равномерное распределение ацетона в баллоне заканчивается через 5 - 7 дней. [23]
При адсорбции паров фенола ( при 20 С упругость 0.1 мм рт. ст.) пик поверхностных групп ОН остается узким и не исчезает столь быстро, как в двух предыдущих случаях. Частота С - Н - кольца и здесь остается неизменной. [24]
При адсорбции паров дифениламина на BiCl3 в сложной спектральной кривой поглощения желтой окраски также вырисовывается максимум у 650 нм, а не в области 500 - 600 нм, характерной для продукта глубокого химического окисления. [25]
При адсорбции паров антрацена на А1203 из полос спектра, приведенных на рис. 3, остается только максимум у 660 нм, приписываемый координационно-связанным молекулам, поскольку он не сопровождается сигналом ЭПР. [26]
Исследована адсорбция паров веществ с относительно крупными молекулами в статических и динамических условиях на образцах промышленных активных углей с различной микропористой структурой. [27]
Изучена адсорбция паров азота, криптона, бензола, к-гексана, н-гептана, метанола и воды на дисперсных минералах разной структуры - тальке, пирофиллите, каолините, гидрослюде, палыгор-ските, монтмориллоните и вермикулите. На основании полученных адсорбционных данных, результатов рентгенографических и электрошшмикроскопических исследований рассмотрены особенности пористой структуры слоистых минералов с жесткой и расширяющейся решеткой, а также слоисто-ленточных минералов. Для талька, пирофиллита, каолинита и гидрослюды определена удельная теплота смачивания по воде. Показано, что поверхностная активность этих минералов зависит от особенностей их структуры. [28]
При адсорбции пара уксусной кислоты на окиси алюминия наблюдались интенсивные полосы поглощения ионов уксусной кислоты при 1335, 1423 и 1585 см-1 и полосы поглощения молекулярно адсорбированной кислоты, взаимодействующей с поверхностными гидроксилами окиси алюминия. Взаимодействие пара уксусной кислоты с двуокисью титана аналогично взаимодействию ее с поверхностью окиси алюминия. [29]
При адсорбции паров органических веществ на активных углях определяющее значение имеют дисперсионные силы; в случае же паров воды адсорбция обязана водородным связям адсорбирующихся молекул с первичными адсорбционными центрами ( кислородными поверхностными соединениями) и с уже адсорбированными молекулами воды. Дисперсионные взаимодействия в этом случае являются слабыми по сравнению с водородными связями и ими можно пренебречь. Так как водородные связи не испытывают усиления в микропорах, то адсорбция молекул в-оды на поверхности стенок микропор происходит так же, как и на поверхности непористого углеродного адсорбента, например газовой сажи, прокаленной в вакууме при 950 С. [30]
Страницы: 1 2 3 4