Адсорбция - другое вещество
Cтраница 1
Адсорбции других веществ из газовой фазы посвящено меньше работ, и они будут рассмотрены параллельно с данными па катализу соответствующих реакций. [1]
Аг значительно превышает адсорбцию других веществ и оно покрывает большую часть поверхности. [2]
Строить изотерму адсорбции пара какого-либо вещества по известной изотерме адсорбции другого вещества с помощью рис. 7 можно также и в том случае, когда на графике отсутствует кривая зависимости Б от р того вещества, изотерму адсорбции которого следует построить. [3]
Пусть реакция происходит с адсорбцией продуктов без перераспределения, причем десорбцией последних и адсорбцией других веществ можно пренебречь. [4]
Если требуется получить вещество в возможно более чистом состоянии путем осаждения или кристаллизации его из раствора, то нужно знать некоторые эмпирические правила, которые относятся к соосаждению и адсорбции других веществ, присутствующих в растворе. При получении веществ в чистом состоянии пытаются по возможности избежать образования смешанных кристаллов и адсорбционных явлений, однако существует немало случаев, когда эти процессы используют для очистки растворов или концентрирования веществ, присутствующих в виде следов. [5]
Находящиеся на поверхности примеси или яды могут оказывать значительно большее влияние на хемосорбцию, чем простая блокировка части поверхности. Кроме влияния на адсорбцию других веществ, которое эти примеси могут оказывать при специфической адсорбции на тонкопористых адсорбентах [234], они могут также воздействовать на отдачу или приобретение поверхностью электронов. Действие поверхностных примесей широко изучалось Рогинским [295], который подразделяет последние на четыре группы, наиболее важная из которых состоит из так называемых модифицирующих примесей. Изменение электрических свойств катализаторов [296] обусловлено именно этими модифицирующими примесями. [6]
Вблизи точки эквивалентности частицы осадка отдают адсорбированные ионы хлора и после точки эквивалентности адсорбируют ионы серебра, приобретая положительный заряд. Изменение заряда частиц осадка сильно влияет на адсорбцию других веществ, находящихся в растворе. [7]
Стремление поверхности уменьшить свою энергию обусловливает и стремление их к снижению поверхностного натяжения. У твердых тел, как правило, поверхностное натяжение снижается вследствие адсорбции других веществ. Адсорбционной способностью обладают и жидкости, па поверхности которых происходит, кроме того, определенное ориентирование молекул. Это особенно характерно для веществ, имеющих несимметричные молекулы. [8]
 |
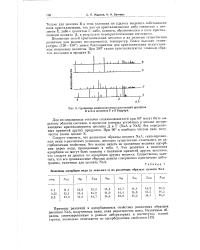
Теплоты адсорбции Н2О, NH3 CU2 и N2 на цеолите Na-X. [9] |
В кубооктаэдры при небольших заполнениях проникает лишь часть молекул Н2О; основная их масса остается в больших полостях. Этот вывод может быть сделан из данных по влиянию предадсорбции небольших количеств Н2О на адсорбцию других веществ. Так, при адсорбции толуола из растворов в н-гептане на цеолите Na-X коэффициент распределения толуола между цеолитом и раствором после предадсорбции - 40 молекул Н2О на элементарную ячейку снижается почти в 25 раз [95], что, согласно [96], свидетельствует о блокировке молекулами Н2О катионов в позициях III, являющихся адсорбционными центрами и для молекул толуола. [10]
Стремление поверхности уменьшить свою энергию обусловливает и стремление к снижению поверхностного натяжения. Твердые тела, как правило, уменьшают свою поверхностную энергию за счет этой составляющей благодаря адсорбции других веществ. К этому способны и жидкости, на поверхности которых благодаря стремлению уменьшить поверхностную энергию происходит, кроме того, определенное ориентирование молекул. [11]
Уравнение (VI.6) отвечает разным случаям кинетики реакций. Рассмотрим некоторые примеры, учитывая в первую очередь случаи адсорбции одного вещества со средней силой и значительно меньшей адсорбции других веществ. [12]
 |
Сравнение межплоскостных расстояний цеолитов В и Е и цеолитов Р и S Баррера. [13] |
Следует отметить, что различные образцы цеолита NaA, синтезированные нами в различных условиях, довольно существенно отличались по адсорбционным свойствам. Эти различия в величинах адсорбции не могут быть связаны с наличием примесей других цеолитов, что следует из данных по адсорбции других веществ. [14]
Доказательство неоднородности поверхности представляют данные по изотопному обмену адсорбированных атомов водорода: скорость обмена на различных адсорбционных центрах существенно различается. В пользу неоднородности поверхности платинового электрода говорит тот факт, что логарифмическая изотерма адсорбции получается не только для атомов водорода, но и при адсорбции других веществ: как заряженных ионов, так и нейтральных молекул. Таким образом, при объяснении закономерностей адсорбции на платине необходимо в первую очередь учитывать энергетическую неоднородность ее поверхности, хотя при адсорбции ионов в значительной степени проявляются и силы отталкивания. [15]
Страницы: 1 2