Адсорбция - тиомочевина
Cтраница 2
Таким образом, существование смешанного адсорбционного слоя возможно при более отрицательных потенциалах, чем это имеет место при адсорбции тиомочевины из раствора, не содержащего соли замещенного аммония, вследствие чего область деполяризующего действия ТМ расширяется. [16]
Кривые, показанные на рис. 58 для метанола, типичны. Во всех системах адсорбция тиомочевины при постоянном заряде дает сильный отрицательный сдвиг потенциала при всех зарядах. Поэтому считают, что диполь тиомочевины постоянно ориентирован на ртутном электроде таким образом, что отрицательный конец ( атом серы) диполя обращен к металлу. [17]
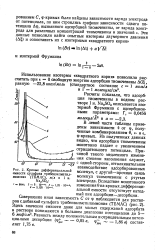 |
Кривые дифференциальной емкости сульфата трибензилметиламмония ( ТБМАС, м / л в 1 н. Na2S04. [18] |
В левой части таблицы приведены зависимости 6 от ф, полученные комбинированием 6, е - и е, Ф - кривых. Из полученных данных видно, что адсорбция тиомочевины монотонно падает с увеличением отрицательного потенцила. Причиной такого медленного изменения степени заполнения служит, с одной стороны, отталкивательное взаимодействие адсорбированных молекул с другой-прочная связь молекул тиомочевины с ртутью электрода. Вследствие монотонного изменения 9 на кривых дифференциальной емкости отсутствует катодный пик адсорбции-десорбции. [19]
 |
Кривая пассивирования цинкового электрода в 2N ZnSO4 ( pH 4 5 при 7к2 ма / см3 и t 8 ( Ваграмян, Соловьева. [20] |
Добавка тиомочевины вызывает появление скачков потенциала после перерывов электролиза, которые, однако, не изменяются с увеличением продолжительности перерывов. Это может свидетельствовать о достаточно высокой скорости адсорбции тиомочевины аа поверхности никеля, но все же более медленной, чем адсорбция дисульфонафталиновой кислоты. [21]
Результаты экспериментальных измерений емкости двойного слоя при различных концентрациях тиомочевины были проанализированы и интерпретированы с помощью методов, ранее применявшихся [59] для объяснения адсорбции тиомочевины из водных растворов. [22]
При введении в электролит конго красного или п-бензолсульфо-азо-нафтилам на, применяемых в виде натриевых солей сульфокислот, в растворе образуются крупные анионы этих соединений, которые вступают в реакцию с комплексными катионами Cu ( CSN2H4) 4, образуя нейтральные молекулы. Это предотвращает их разряд и включение в осадок и, таким образом, устраняет хрупкость. По-видимому, на адсорбцию тиомочевины эти добавки не влияют, так как блеск медных осадков не ухудшается. [23]
Опыты показали, что возникающий под действием тиомочевины предельный ток при ускорении вращения электрода не только не увеличивается, а наоборот - уменьшается. Кроме того, в присутствии тиомочевины отмечается увеличение катодной поляризации при усилении перемешивания электролита. Эти результаты в сочетании с другими выявленными закономерностями показали, что наблюдаемая катодная поляризация имеет химический характер и, в основном, вызвана адсорбцией тиомочевины на поверхности электрода. [24]
Аналогичное изменение высоты пика было найдено в случае адсорбции тиомочевины на ртути из водных растворов нитрата калия. Здесь кривые имеют значительно более симметричную форму, откуда следует, что изотерма Фрумкина лучше описывает эту систему, чем изотерма Гельфанда, Фриша и Лебовица. Возможно, что это результат образования химической связи между атомом серы из молекулы тиомочевины и атомом ртути. Таким образом, при адсорбции тиомочевины существуют определенные адсорбционные участки, которых, по-видимому, нет, когда адсорбируются ионы бензолдисуль-фоната или иода. В случае жидкой поверхности это позволяет установить различие между хемисорбцией и физической адсорбцией. [25]
Страницы: 1 2