Адсорбция - атомарный водород
Cтраница 3
Затем, начиная с т ] 50 мв, снова имеет место падение сопротивления приблизительно до т ] 110 мв, после чего оно опять растет. Можно считать, что в области т ] от 50 мв почти до 400 мв определяющей является адсорбция атомарного водорода на поверхности платины. При поляризации электрода комплексное сопротивление в этой области изменяется соответственно дифференциальной адсорбционной емкости. [31]
Затем начиная с ц 50 же снова имеет место падение сопротивления приблизительно до т) 110 мв, после чего оно опять растет. Можно считать, что в этой области от TJ 50 мв почти до 400 мв определяющей является адсорбция атомарного водорода на поверхности платины. При поляризации электрода комплексное сопротивление в этой области изменяется соответственно дифференциальной адсорбционной емкости. [32]
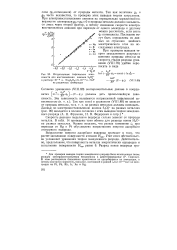 |
Исправленные тафелевские зависимости для восстановления анионов S2Ojj - в растворе Ю-3 н. Na2S2O8 9 - Ю 3 н. NaF. [33] |
Скорость реакции выделения водорода сильно зависит от природы металла. В табл. 14 приведены токи обмена для разряда ионов Н3О на разных металлах. Можно показать, что резкое изменение / 0 при переходе от Hg к Pt обусловлено возрастанием энергии адсорбции атомарного водорода. [34]
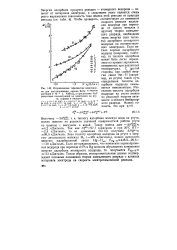 |
Исправленные тафелевские зависимости для восстановления аниона ВгОГ в В ДНОМ растворе 2 - 10 - 4 н. NaBrO4 в присутствии NaF различных концентраций на электродах из ртути, сурьмы и висмута. [35] |
Такая оценка дает - АЯ о 4 2 кДж / моль. Так как Л 0Сб) 97 7 кДж / моль и при 20 С ЯГ 2 4 кДж / моль, то из уравнения (53.13) получаем АЯЦДС 99 5 кДж / моль. Если же предположить, что изменение перенапряжения водорода при переходе от Pt к Hg целиком обусловлено изменением энергии адсорбции атомарного водорода, то получается Еце - н & ж ИЗ кДж / моль. Таким образом, экспериментальные данные подтверждают основные положения теории замедленного разряда о влиянии материала электрода на скорость электрохимической реакции. [36]
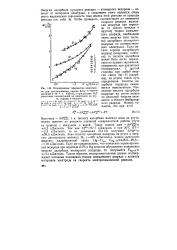 |
Исправленные тафелевские зависимости для восстановления аниона ВгОГ в В ДНОМ растворе 2 - 10 - 4 н. NaBrO4 в присутствии NaF различных концентраций на электродах из ртути, сурьмы и висмута. [37] |
Такая оценка дает - АЯйдо 4 2 кДж / моль. Так как Л 0Сб) 97 7 кДж / моль и при 20 С ЯГ 2 4 кДж / моль, то из уравнения (53.13) получаем АЯЦДС 99 5 кДж / моль. Если же предположить, что изменение перенапряжения водорода при переходе от Pt к Hg целиком обусловлено изменением энергии адсорбции атомарного водорода, то получается Еце - н & ж ИЗ кДж / моль. Таким образом, экспериментальные данные подтверждают основные положения теории замедленного разряда о влиянии материала электрода на скорость электрохимической реакции. [38]
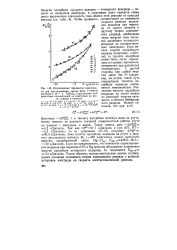 |
Исправленные тафелевские зависимости для восстановления аниона ВгОГ в В ДНОМ растворе 2 - 10 - 4 н. NaBrO4 в присутствии NaF различных концентраций на электродах из ртути, сурьмы и висмута. [39] |
Такая оценка дает - АЯ о 4 2 кДж / моль. Так как Л 0Сб) 97 7 кДж / моль и при 20 С ЯГ 2 4 кДж / моль, то из уравнения (53.13) получаем АЯЦДС 99 5 кДж / моль. Если же предположить, что изменение перенапряжения водорода при переходе от Pt к Hg целиком обусловлено изменением энергии адсорбции атомарного водорода, то получается Еце - н & ж ИЗ кДж / моль. Таким образом, экспериментальные данные подтверждают основные положения теории замедленного разряда о влиянии материала электрода на скорость электрохимической реакции. [40]
Оба уравнения тождественны и находятся в соответствии с экспериментальными данными. Некоторая особенность предложенной схемы заключается в том, что в ней предусмотрено наличие на поверхности платины в кислоте адсорбированных водородных атомов при потенциале около 0 9 в. Однако все имеющиеся в литературе данные об адсорбции водорода на платине получены в атмосфере водорода и не могут быть перенесены на окисленную платину. Возможно, что на платпне в атмосфере кислорода адсорбция атомарного водорода значительно выше, чем на платине, находящейся в атмосфере водорода. [41]
Возможно некоторое отклонение от этой общей закономерности, связанное с тем, что на включение водорода в металл влияет ряд дополнительных фактов, как. С другой стороны, в некоторых случаях, как, например, в случае палладия, возникают экспериментальные трудности в определении наводороживания вследствие быстрого удаления водорода из металла, что затрудняет учет. Это приводит к тому, что при сравнении наводороживания для одних металлов учитывается преимущественно равновесная часть включенного водорода, а для других - наряду с равновесной учитывается и неравновесная его часть. При электролитическом выделении металлов водород включается в металл разными путями, а именно, путем механического захвата и в результате адсорбции атомарного водорода на поверхности. Адсорбированный водород частично переходит в решетку с образованием твердых растворов или интерметаллических соединений, а частично рекомбинирует в молекулярный водород. Разряжаясь одновременно с ионами металла, ионы водорода адсорбируются на грани кристалла и по мере роста кристаллической решетки включаются в нее, занимая ее узлы или располагаясь между ними. Твердый раствор может образовываться в результате непосредственного включения ионов водорода в кристаллическую решетку в виде протонов с уравновешиванием общими электронами металла, а не путем включения адсорбированных атомов в решетку. В пользу протонного типа включения водорода в осадок говорит тот факт, что в кислых растворах металл наводороживается значительно больше, чем в щелочных. [42]
Это - активированная адсорбция [3] и ее скорость слишком мала, чтобы ее измерять при низких температурах. Вследствие низкой теплоты адсорбции ( Юккал / молъ) при комнатной температуре и давлении 10 - 2 мм рт. ст. равновесное заполнение слишком мало для объемных измерений. При этом принимают, что ПП связан со степенью заполнения таким же образом, как и при - 78 С, когда адсорбцию атомарного водорода удается определять диодным методом. [43]
В последние годы в основном в связи с разработкой топливного элемента значительное внимание уделялось проблеме адсорбции на твердых электродах, таких, как платина и другие благородные металлы. Вопросы, возникающие при рассмотрении твердых электродов, значительно отличаются от аналогичных вопросов в случае ртути. Например, для твердых электродов нельзя пользоваться классическим термодинамическим методом вычисления поверхностного избытка вещества, поскольку здесь трудно измерить поверхностное натяжение и потенциал нулевого заряда В этих системах адсорбцию изучают методами, упоминавшимися в разд. Адсорбция атомарного водорода вблизи обратимого водородного потенциала, а также образование окиси платины ( или адсорбция кислорода) при более положительных потенциалах еще более осложняет работу на платиновом электроде. Потенциал нулевого заряда ртути относительно стандартного водородного электрода в водных растворах в отсутствие специфической адсорбции составляет около - 0 2 В. [44]
Левая потенциальная кривая отражает изменение свободной энергии системы М - Не расстоянием между адсорбированным атомом водорода и поверхностью металла. При движении в том же направлении ( от точки пересечения кривых) потенциальная энергия уменьшается за счет сил притяжения между поверхностью металла и атомом водорода при их сближении. Таким образом, изменение потенциальной энергии водородного иона в процессе разряда описывается участком потенциальной кривой ABC. Изменение энергии на пути СВА отвечает обратному процессу - ионизации адсорбированного атома водорода с получением гидратированного водородного иона. Если бы в точке В не происходило присоединения электрона при разряде ( или его потери при ионизации), то правая и левая кривые были бы доведены соответственно до уровней D и F. Уровень D характеризует величину потенциальной энергии системы Н Н2О, состоящей из свободного газообразного протона и жидкой воды. Разница между точками D и А дает полную реальную энергию гидратации иона водорода. Уровень F соответствует потенциальной энергии системы Н М, состоящей из свободных газообразных атомов водорода и твердого металла. Разница между точками F и С дает энергию адсорбции атомарного водорода электродным металлом. Из рис. 69 следует, что энергия активации разряда меньше, чем полная энергия дегидратации. Точно так же энергия активации ионизации должна быть меньше энергии десорбции атома водорода с поверхности металла. Так, например, энергия активации разряда водородных ионов на ртути при нулевом перенапряжении составляет примерно 20 ккал / г-ион, в то время как энергия гидратации водородных ионов близка к 250 ккал / г-ион. Тем не менее энергия активации разряда, а следовательно, и перенапряжение водорода, должны зависеть от энергии сольватации водородных ионов и от энергии ( или теплоты) адсорбции водородных атомов. Следовательно, по теории замедленного разряда величина перенапряжения водорода должна закономерно снижаться с повышением адсорбционной способности электродного металла по отношению к атомам водорода. С другой стороны, по теории замедленного разряда при выделении водорода на данном металле величина перенапряжения должна зависеть от энергетического состояния иона в растворе. Следует ожидать поэтому ее изменения также при переходе от одного растворителя к другому. [45]
Страницы: 1 2 3