Адсорбция - хлор-ион
Cтраница 2
Точечная и язвенная коррозия нержавеющих сталей часто встречается при эксплуатации в морской воде. Механизм точечной и язвенной коррозии связан с адсорбцией хлор-ионов на нек-рых участках поверхности стали, вследствие чего происходит локализация коррозии. Точечная коррозия в присутствии хлор-ионов может быть вызвана пробоем пассивной пленки при высоком потенциале. [16]
 |
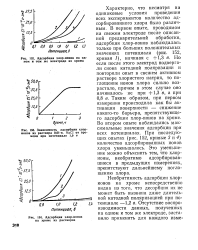
Зависимость коррозионно-усталостной выносливости сплавов. [17] |
Скорость разрушения окисной пленки возрастает в ряду анионов фтор-иод-бром-хлор, в котором снижается радиус ионов и возрастает их пептизирующая способность. Адсорбционная теория связывает активирующее действие хлоридов при достижении определенного потенциала с адсорбцией хлор-ионов, вытесняющих кислород из окисной пленки. Возможно также разрушение ( перфорирование) защитных пленок в отдельных участках вследствие образования хемосорбционных соединений между адсорбированным хлором и алюминием в стехиометрическом соотношении, отвечающем хлористому алюминию. [18]
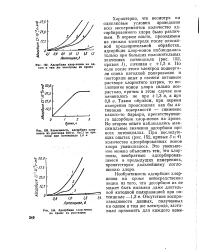 |
Зависимость адсорбции хлор-ионов иа раствора 0 01 - н, NaCl от времени при потенциале 1 0 в.| Адсорбция хлор-ионов на хроме из растворов. [19] |
Характерно, что несмотря на одинаковые условия проведения всех экспериментов количество адсорбированного хлора было различным. В первом опыте, проводимом на свежем электроде после описанной предварительной обработки, адсорбция хлор-ионов наблюдалась только при больших положительных значениях потенциала ( рис. 152, кривая /), начиная с 1 3 в. Но если после этого электрод подвергали снова катодной поляризации и повторяли опыт в свежем активном растворе хлористого натрия, то поглощение ионов хлора сильно возрастало, причем в этом случае оно начиналось не при 1 3 в, а при 0 8 в. [20]
Характерно, что несмотря на одинаковые условия проведения всех экспериментов количество адсорбированного хлора было различным. В первом опыте, проводимом на свежем электроде после описанной предварительной обработки, адсорбция хлор-ионов наблюдалась только при больших положительных значениях потенциала ( рис. 152, кривая 1), начиная с 1 3 в. Но если после этого электрод подвергали снова катодной поляризации и повторяли опыт в свежем активном растворе хлористого натрия, то поглощение ионов хлора сильно возрастало, причем в этом случае оно начиналось не при 1 3 в, а при 0 8 в. [22]
Высокое значение энергии активации процесса растворения стали 1Х18Н9Т в 18 % - ной H2SO4 и незначительное его изменение при добавлении NaCl ( табл. 3) подтверждают предположение, легшее в основу хемосорбционной теории, о том, что скорость всего процесса как с добавкой галоида, так и без нее определяется скоростью электрохимических реакций, которые тормозятся добавками NaCl примерно в равной степени ( табл. 5 и фиг. Некоторое преобладание торможения анодного процесса при добавлении NaCl до 30 г. л указывает на адсорбцию хлор-ионов в первую очередь на наиболее активных участках поверхности. [23]
Исходя из пленочного механизма пассивности, принято считать, что началом образования питтинга [7, 8] является адсорбция хлор-ионов в наиболее анодных участках и последующее химическое растворение ими пассивного слоя в этих местах. По адсорбционной теории [9-11] локальная депассивация металла хлор-ионами происходит вследствие адсорбционного вытеснения ими кислорода. [24]
 |
Вид ножевой коррозии сварных образцов из стали Х18Н9Т. [25] |
Точечная и язвенная ко р-розия нержавеющих сталей часто встречается при эксплуатации в морской воде. В ряде случаев она может иметь перфорирующий характер ( для листа и ленты); Механизм точечной и язвенной коррозии связан с адсорбцией хлор-ионов на нек-рых участках поверхности стали, вследствие чего происходит локализация коррозии. Точечная коррозия в присутствии хлор-ионов может быть вызвана пробоем пассивной пленки при высоком потенциале. [26]
Однако пигменты лучшего качества получаются, если исходной солью служит сульфат кадмия; при работе с хлоридом кадмия происходит спекание осадка и резкое ухудшение его цвета вследствие адсорбции хлор-иона осадком при прокаливании. [27]
Это обусловлено двойственным характером анодной поляризации. Любое смещение потенциала за стационардые значения увеличивает, с одной стороны, степень окисления поверхности, что затрудняет активирование поверхности стали хлор-ионом, и, с другой, облегчает адсорбцию хлор-ионов, а стало быть, и вытеснение ими кислорода. При малых плотностях тока преобладает пассивирующее действие кислорода, и поэтому хлор-ионы не могут активировать металл, несмотря на то, что потенциал намного положительнее потенциала питтингообразования. [28]
Это обусловлено двойственным характером анодной поляризации. Любое смещение потенциала за стационарлые значения увеличивает, с одной стороны, степень окисления поверхности, что затрудняет активирование поверхности стали хлор-ионом, и, с другой, облегчает адсорбцию хлор-ионов, а стало быть, и вытеснение ими кислорода. При малых плотностях тока преобладает пассивирующее действие кислорода, и поэтому хлор-ионы не могут активировать металл, несмотря на то, что потенциал намного положительнее потенциала питтингообразования. [29]
Механизм депассивирующего действия хлоридов состоит в следующем. Адсорбция хлоридов поверхностью металла, по-видимому, ведет к вытеснению и замещению ионов кислорода в пассивирующей пленке на ионы хлора. После такой замены в точках адсорбции хлор-ионов получается растворимое хлористое соединение металла, что ведет к образованию пор в защитной пленке. [30]
Страницы: 1 2 3