Адсорбция - двуокись - углерод
Cтраница 2
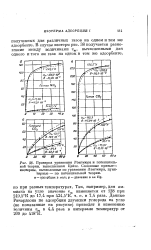
Изотермы адсорбции двуокиси углерода при 20 на опытных гранулированных образцах цеолита NaA, полученных нами от Б. А. Липкинда и Я. В. Мирского ( рис. 3), поднимаются в начальной области менее круто. [16]
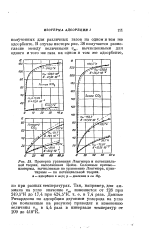
Изотермы адсорбции двуокиси углерода кусковым силикагелем КСМ при температур ах от - 110 до - 150JC и давлениях воздуха от 1 до 145 ата показаны на фиг. [17]
Изотермы адсорбции двуокиси углерода кусковым силикагелем КСМ при температурах от 163 до 123 К и давлениях воздуха от 0 1 до 14 5 Мн / м показаны на рис. 2, где статическая емкость выражена в кубических сантиметрах СО2 ( при температуре 293 К и давлении 760 мм рт. ст.) на 1 г адсорбента. Ход изотерм показывает, что с повышением давления воздуха емкость адсорбента вначале возрастает, проходит через максимуму а затем уменьшается и при давлениях выше 12 5 Мн / м2 остается практически постоянной. [18]
Теплоты адсорбции двуокиси углерода на окиси серебра и на окиси меди, определенные методом ГХ. [19]
Исследована также адсорбция двуокиси углерода U6 - 122 активированным углем. [20]
Определены изотермы адсорбции двуокиси углерода из сжатого атмосферного воздуха, содержащего 0 03 % СС2, при температуре 20 С промышленными образцами цеолитов СаА и NaX. Полученные величины статической емкости указывают на целесообразность их использования для адсорбционной очистки воздуха высокого давления от COz при положительных температурах. [21]
Данные Ричардсона по адсорбции двуокиси углерода на угле ( не показанные на рисунке) приводят к изменению величины пт в 4 4 раза в интервале температур от 209 до 418 К. [23]
Экспериментальные данные по адсорбции двуокиси углерода и этилена на порошке золота, а также этилена на пирофорном железе [53] не согласуются с теорией. Данные для железа сильнее отклоняются от уравнения ( 62), чем данные, полученные для золота. Магнус приписывает эти отклонения активированной адсорбции на металлах и обращает внимание на тот факт, что наибольшее значение теплоты адсорбции, полученное для этилена на угле, составляет около 7500 кал / моль, тогда как максимальные значения теплоты адсорбции того же газа на золоте и на железе равны соответственно 9500 и 11 700 кал / моль. Однако мы увидим далее, что подобное различие недостаточно велико, чтобы его с полной определенностью можно было приписать активированной адсорбции. [24]
Данные Ричардсона по адсорбции двуокиси углерода на угле ( не показанные на рисунке) приводят к изменению величины vm в 4 4 раза в интервале температур от 209 до 418 К. [26]
Экспериментальные данные по адсорбции двуокиси углерода и этилена на порошке золота, а также этилена на пирофорном железе [53] не согласуются с теорией. Данные для железа сильнее отклоняются от уравнения ( 62), чем данные, полученные для золота. Магнус приписывает эти отклонения активированной адсорбции на металлах и обращает внимание на тот факт, что наибольшее значение теплоты адсорбции, полученное для этилена на угле, составляет около 7500 кал / моль, тогда как максимальные значения теплоты адсорбции того же газа на золоте и на железе равны соответственно 9500 и 11 700 кал / моль. Однако мы увидим далее, что подобное различие недостаточно велико, чтобы его с полной определенностью можно было приписать активированной адсорбции. [27]
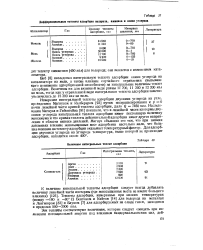 |
Дифференциальные теплоты адсорбции водорода, аммиака и окиси углерода. [28] |
Измерение интегральной теплоты адсорбции двуокиси углерода на угле, проведенное Магнусом и Келберером [93] путем экстраполирования к р О почти линейной части кривой теплоты адсорбции, дало Q 7450 кал. Исследования Магнуса и Гибенгейна [91] показали, что в линейной части изотермы двуокиси углерода интегральная теплота адсорбции имеет постоянную величину максимума и что кривая теплоты действительной адсорбции имеет другое направление в области низких - давлений. Магнус объяснял это тем, что при низких давлениях влияние ненасыщенных мест адсорбента настолько мало, что большее влияние на теплоту адсорбции оказывает температурный фактор. [29]
Экспериментальная методика заключается в адсорбции двуокиси углерода на прозрачной пластинке, алюмосиликата, помещенной в ИК-кювете при 2 - 3 мм рт. ст. и комнатной температуре. [30]
Страницы: 1 2 3 4