Возможность - титрование
Cтраница 3
Черкашина [ 231 изучала возможность титрования галлия в растворах с различными значениями рН в присутствии ализарина, ализарина красного S, хинализарина, нитробензолазопирокатехина, галлоцианина. Наиболее подходящим индикатором оказался ализарин красный S. [31]
Добавление лимонной кислоты открывает возможность успешного титрования вольфрама в присутствии фосфора, например при анализе стали. [32]
 |
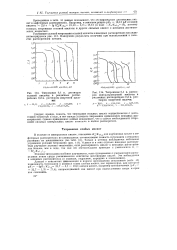
Мост для измерения электропроводности. [33] |
Такими же критериями определяется возможность титрования смесей оснований с солями слабых кислот. [34]
Кашима и Кано показали возможность титрования солей слабых кислот по вытеснению в безводной пропионовой кислоте. [35]
К достоинствам перманганатометрического метода относят: 1) возможность титрования раствором КМпС в любой среде ( кислой, нейтральной, щелочной); 2) применимость растворов перм-анганата калия в кислой среде для определения многих веществ, которые не взаимодействуют с более слабыми окислителями; 3) стехиометричиость большинства окислительно-восстановительных реакций с участием МпОг - при оптимально выбранных условиях с достаточной скоростью; 4) возможность титрования без индикатора; 5) доступность перманганата калия. [36]
В основу метода, описанного ниже, положена возможность титрования первичных и вторичных аминов в форме соответствующих дитиокарбаминовых кислот. При выполнении этого метода пробу, содержащую ангидрид, прибавляют к точно известному избытку раствора морфолина и титруют свободную кислоту, присутствующую в пробе, и кислоту, образовавшуюся в результате реакции ангидрида с морфолином. В условиях титрования избыточный морфолин не оказывает помех. Прибавляя сероуглерод вблизи точки эквивалентности титрования кислот, морфолин превращают в дитиокарбаминовую кислоту и ее титруют раствором щелочи. Разность между результатами холостого титрования и второго титрования пробы является мерой количества ангидрида, содержащегося в пробе. Разность между результатами обоих титрований пробы соответствует содержанию свободной кислоты в пробе. [37]
В щелочной среде индикатор легко окисляется, что исключает возможность титрования со свидетелем и делает неудобным применение индикатора. [38]
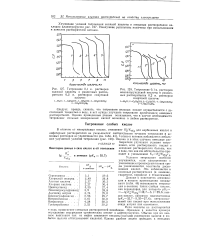
Ось ( E-D) на рис. 3.9 предназначена для прогнозирования возможности титрования самого слабого ( п-го) компонента смеси. Если при титровании образуются ассоциированные соли, их влияние отражается поправкой Rn, устанавливаемой по графику на рис. 3.10, в в зависимости от константы диссоциации соли и концентрации компонента. [39]
Данные о константах диссоциации и ионном произведении показывают ( табл. 44) возможность титрования в аммиаке таких слабых кислот, как сероводород, для которого р / ( т - - lgA / Ko6A32 7 - 3 1 29 6; амидов кислот, например цианацетамида ( рКт 32 7 - 5 3527 4); нитросоеди-нений как кислот при использовании амида натрия как основания. [41]
Данные о константах диссоциации и ионном произведении показывают ( табл. 42) возможность титрования в аммиаке таких слабых кислот, как сероводород, для которого pKj - - lgKn / KobA 32 7 - 3 1 29 6; амидов кислот, например цианацетамида ( рА т 32 7 - 5 35 27 4); нитросоединений как кислот при использовании амида натрия как основания. [43]
Рассмотрим, например, титрование ионов Са2 с эриохро-мовым черным Т при рН 8 и 11, когда возможность титрования ( см. рис. 15.7) сомнений не вызывает. [44]
К сожалению, количественные данные, необходимые для построения кривых титрования в неводных растворителях, обычно отсутствуют, поэтому возможность титрования оценивается лишь качественно. В таких случаях весьма полезной оказывается теория Бренстеда ( см. стр. [45]
Страницы: 1 2 3 4