Начальная адсорбция
Cтраница 1
Величина начальной адсорбции связана с поверхностной активностью раствора. Краситель осаждается на поверхности волокна, которая, будучи неполярной, является поверхностью раздела для адсорбции поверхностно-активных веществ. [1]
Звездочками отмечены углеродные атомы, начальная адсорбция которых приводит к образованию шестичленного цикла. Двумя звездочками отмечен атом углерода, который может вызвать циклизацию, образуя новую связь с метиленовым углеродом основной или с метильным углеродом боковой цепи: вероятность, определяемая этим углеродом, удваивается; адсорбция неотмеченных углеродных атомов вызывать циклизацию не может. [2]
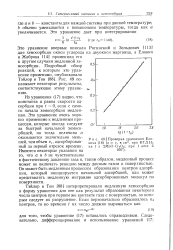 |
Проверка уравнения Ело. [3] |
Он может быть медленным процессом образования центров адсорбции, который инициируется начальной адсорбцией, или может представлять медленную миграцию адсорбированных молекул по поверхности. [4]
Кривые теплот сорбции паров изученных сорбатов на монтмориллоните [8, 9] характеризуются относительно высокими значениями при начальных адсорбциях и постепенным спадом с ростом степени заполнения, приближаясь к теплоте конденсации. Причем эта разница & QQd-Qa уменьшается с ростом адсорбции, что согласуется с донорной способностью молекул сорбатов. Так, в начальной области заполнения поверхности монтмориллонита циклогексаном Д ( составляет 2 - 3 кДж / моль, а при использовании в качестве адсорбата ацетонитрила возрастает до 24 - 25 кДж / моль. [5]
Почленным перемножением этих двух отношений получаем отношение 3: 4: 10, которое определяет вероятность начальной адсорбции молекулы посредством любого из ее углеродных атомов. [6]
В относительной скорости процессов с участием 02 на металлах и их окисленных поверхностях существенную роль могут играть эффекты тт-орбиталей в начальной адсорбции 02 ( ср. [7]
На основании изучения кинетики гидролиза п-нитрофенил-ацетата [6] и 2 4-динитрофенилацетата [8] по методу остановленного потока мы можем различить три стадии в этих реакциях: первая - начальная быстрая адсорбция субстрата, вторая - освобождение одного моля нитрофенола на моль химотрипсина и сопутствующее ацилирование группы у фермента и третья - гидролиз соединения фермент-ацил. Стадия начальной адсорбции протекает слишком быстро и не поддается измерению имеющимися в настоящее время методами. Эти величины характеризуют химическую реакцию между группами на каталитическом центре и субстратом и могут быть использованы в отдельности. Как освобождение ионов нктрофенилата, так и освобождение или связывание ионов водорода протекает во время обеих последовательных реакций. Найдено, что во время первой из них освобождается только нитрофенол, тогда как ацетат реагирует с ОН-группой фермента. Полученное соединение ацил-фермент во время конечной стадии гидролизуется с освобождением ацетата. Как ацилирование, так и гидролиз ацил-фермента ингиби-руется путем присоединения протона к соседней основной группе, вероятно имидазольной. В литературе приведено большое число доказательств, 8 ] в пользу того, что ацилируется именно гидроксильная группа в остатке серина в химотрипсине. [8]
Площадь поверхности напыленных пленок обычно много больше их видимой поверхности. Контакт с малыми количествами адсорбируемого газа приводит к начальной адсорбции на внешней поверхности. Если адсорбат очень подвижен, его перераспределение в пористой структуре происходит быстро, если адсорбат неподвижен, заполнение внутренних участков поверхности будет происходить только при дальнейшем поступлении газа путем диффузии в открытые поры. Поверхностный потенциал, само собой разумеется, дает информацию только о внешней поверхности; таким образом, можно заключить, что если при общем малом заполнении значение поверхностного потенциала медленно возрастает до величины насыщения, то адсорбат мало подвижен, равномерное постепенное увеличение отражает большую подвижность при температуре адсорбции. Этот метод состоит в измерении зависимости ПП от количества ксенона, введенного в систему. Полное заполнение соответствует резко выраженному значению насыщения поверхностного потенциала. [9]
Было показано, что полимеризация этиленимина на Мо03 протекает со значительным периодом индукции ( от 40 до 80 мин в зависимости от температуры тренировки катализатора) и автокаталитическим ускорением. Изучение кинетики полимеризации этиленимина ( и окиси этилена для сравнения) на окиси алюминия и алюмосиликате весовым методом [40] показало, что после быстрой начальной адсорбции ( теплота адсорбции8 2 ккоиДиоль) мономера в количестве приблизительно монослоя ( - 10 - Б молъ / м при 25 С) начинается его полимеризация ( энергия активации 25 ккал / молъ) с постоянной скоростью. Полимер образует жидкую пленку на поверхности катализатора. [10]
Эти соображения помогают нам объяснить преимущественное образование соединений изо-строения и позволяют предвидеть их содержание в общем выходе продуктов размыкания. Вероятность начальной адсорбции гомолога циклобутана каждым углеродным атомом соответствует по пространственным соображениям количеству связанных с ним атомов водорода. [11]
Интересно отметить, что все упомянутые здесь органические соединения с длинными углеводородными цепями имеют как полярные, так и неполярные концы. Полярный конец молекулы ингибитора принимает участие в адсорбционном процессе. Будет ли начальная адсорбция действительно хемосорбцией или физической адсорбцией, обусловленной силами Ван-дер - Ваальса, с последующей хемосорбцией, - еще окончательно не установлено. Брестон [110] утверждает, что, по-видимому, оба процесса совершаются одновременно; хемосорбция происходит на активных участках, а оставшаяся часть поверхности покрывается ингибитором за счет слабых физических сил. Однако при этом через короткий промежуток времени должна возникнуть сильная ковалентная связь между полярной группой ингибитора и поверхностью металла. [12]
При физической адсорбции равновесие часто устанавливается настолько быстро, что скорость этого процесса не удается измерить. Однако это не является общим правилом. Во многих случаях вслед за быстрой начальной адсорбцией следует медленный сорбцион-ный процесс. Природа этого медленного процесса может быть в отдельных случаях различной: начиная от хемосорбции и кончая истинной химической рэак-цией. Так, например, Шах [3] нашел, что в случае адсорбции кислорода на древесном угле при 0 большая часть газа выделяется при откачке при той же температуре в виде кислорода. Однако некоторая часть газа удаляется только при более высокой температуре, причем этот газ оказывается уже но кислородом, а смесью двуокиси и окиси углерода. Таким образом, хотя большая часть кислорода удерживается углем за счет ван-дер-ваальсовой адсорбции, однако некоторая часть его оказывается связанной с поверхностными атомами углерода настолько прочно, что откачка при повышенной температуре приводит к удалению этих атомов углерода вместе с кислородом. [13]
При физической адсорбции равновесие часто устанавливается настолько быстро, что скорость этого процесса не удается измерить. Однако это не является общим правилом. Во многих случаях вслед за быстрой начальной адсорбцией следует медленный сорбцион-ный процесс. Природа этого медленного процесса может быть в отдельных случаях различной: начиная от хемосорбции и кончая истинной химической реакцией. Так, например, Шах [3] нашел, что в случае адсорбции кислорода на древесном угле при 0 большая часть газа выделяется при откачке при той же температуре в виде кислорода. Однако некоторая часть газа удаляется только при более высокой температуре, причем этот газ оказывается уже но кислородом, а смесью двуокиси и окиси углерода. Таким образом, хотя большая часть кислорода удерживается углем за счет ван-дер-ваальсовой адсорбции, однако некоторая часть его оказывается связанной с поверхностными атомами углерода настолько прочно, что откачка при повышенной температуре приводит к удалению этих атомов углерода вместе с кислородом. [14]
Викор 7930) получили результаты, способные объяснить это различие в интерпретациях. Они нашли, что для аммиака при 150 график зависимости оптической плотности ( рис. 7) полосы поглощения, приписанной ОН-группам, связанным водородной связью, от степени заполнения поверхности не проходит через начало координат. Как указал Йетс в недавно опубликованном обзоре [39], это лучше всего объяснять начальной адсорбцией, протекающей на поверхностных атомах кремния или кислорода, за которой следует адсорбция на изолированных ОН-группах. Поскольку в предыдущих исследованиях не были получены изотермы адсорбции, различные интерпретации могут быть полностью обусловлены различиями в заполнении поверхности. [15]
Страницы: 1 2