Более сильная адсорбция
Cтраница 1
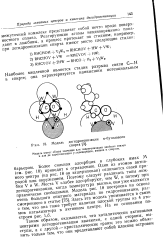 |
Модель дегидрогенизации к-бутилового спирта [ 31. [1] |
Более сильная адсорбция в глубоких ямах М ( см. рис. 18) приводит к отравлению. Один из атомов активного центра ( на рис. 18 он заштрихован) отличается своей природой или окружением. Поэтому следует различать типы ложбин V и W. Места V слабее адсорбируют, чем W, и потому при дегидрогенизации, когда температура высока, они уже являются практически свободными. Здесь эта модель упоминается в связи с тем, что она тоже требует наличия плоской группы из 4 атомов катализатора в активном центре. [2]
Более сильная адсорбция бутадиена-1 3 по сравнению с бутеном-1 ( см. раздел III, E, 6) позволяет думать, что обе олефиновые связи взаимодействуют с поверхностью. [3]
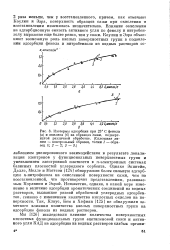 |
Изотермы адсорбции при 25 С фенола ( а и анилина ( б на образцах сажи, подвергнутой различной обработке. ( Сплошная линия - контрольный образец, точки 1 - образец 1. 2 - 2. 3 - 3. [4] |
Однако Эпштейн, Далле, Молле и Маттсон [124] обнаружили более сильную адсорбцию и-нитрофенола на окисленной поверхности сажи, чем на восстановленной, что противоречит представлениям, развиваемым Коулином и Эзрой. Неизвестно, однако, в какой мере изменение в величине адсорбции ароматических соединений из водных растворов, вызванное разной обработкой углеродных адсорбентов, связано с изменением количества кислотных окислов на поверхности. Так, Клаус, Бем и Хофман [125] не обнаружили заметного влияния количества кислых поверхностных групп на адсорбцию фенола из водных растворов. [5]
 |
Изотермы адсорбции полистирола со средней молекулярной массой 300000 из растворов в ССЦ силикагелями с гидроксилированной поверхностью с различными эффективными диаметрами пор. [6] |
В случае растворов полистирола в толуоле, на гидрокеилированной поверхности аэросила происходит более сильная адсорбция полярных молекул растворителя - толуола, специфически взаимодействующих с силанольными группами поверхности. [7]
При использовании газоадсорСционной хроматографии анализируемые пробы ( в большинстве случаев это постоянные газы и низкомолекулярные углеводороды) разделяются в результате более сильной адсорбции на активном твердом носителе лучше, чем в жидкой фазе. В качестве твердых носителей используют такие активные адсорбенты, как ок1Сь алюминия, уголь, силикагель и разные типы молекулярных сит. [8]
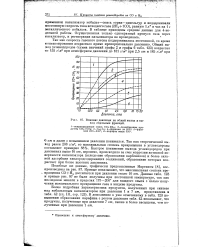 |
Влияние давления на общий выход и выход отдельных фракций. [9] |
Быстрое понижение выхода углеводородов при давлениях выше 16 am, вероятно, происходило за счет коррозии активной поверхности катализатора ( вследствие образования карбонилов) и более сильной адсорбции кислородсодержащих соединений, образование которых возрастает при более высоких давлениях. [10]
Это же уравнение было выведено теоретически Ру-дерсхаузеном и Ватсоном [132], исходившими из предположения об углеобразовании как процессе полимеризации ненасыщенных соединений, адсорбированных на поверхности катализатора, и из предположения о более сильной адсорбции углистого вещества, чем всех других продуктов. [11]
На всех металлах, за исключением иридия и осмия, селективности и распределения для олефина, наблюдавшиеся в первой реакции, были постоянны или изменялись мало до тех пор, пока диен отсутствовал, что указывало также на более сильную адсорбцию диена по сравнению с бутенами. [12]
Более сильную адсорбцию 1 4-диаминоантрахинона в сравнении с 1 8-изомером и р-аминоантрахиноном можно объяснить двояко. Симметричное расположение полярных центров в молекуле 1 4-диаминоантрахинона вероятно также способствует адсорбции. [13]
Специфическая адсорбция катиона ( C g N из N-метилформамида, как сообщали Дамаскин и Поваров [9], значительно слабее, чем из водного раствора. Это было отнесено за счет более сильной адсорбции растворителя в растворах N-метилформамида. Однако более важным фактором, вероятно, является более сильная сольватация иона в N-метилформамиде. Максимальное понижение емкости происходит в области горба, так как, согласно теории переориентации диполей, объясняющей появление горба, растворитель может менее прочно удерживаться в этой области. [14]
Поскольку в процессе уничтожения дефектов площадь любой данной грани может уменьшиться в очень большой степени, а при высвобождении энергии напряжения изменяются межатомные расстояния, едва ли можно в настоящее время считать доказанным, что каталитически активные центры локализуются на дефектах кристаллической решетки и дислокациях. Представляется более разумным считать грань кристалла однородной по активности, причем нет необходимости исключать возможность более сильной адсорбции и даже несколько модифицированной химической активности на дислокациях. [15]
Страницы: 1 2 3