Активированная адсорбция
Cтраница 3
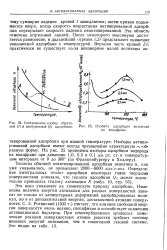 |
Соотношение изобар обратимой ( / и необратимой 2 адсорбции.| ИзобаРа адсорбции водорода на вольфраме. [31] |
Изобары активированной адсорбции имеют всегда чрезвычайно характерную - - об-разную форму. [32]
Теория активированной адсорбции не смогла стать, как это первоначально задумал Тэйлор, общей теорией адсорбционных процессов. [33]
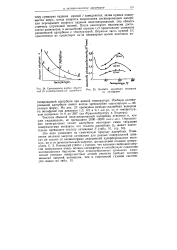 |
Соотношение изобар обратимой ( / и необратимой ( 2 адсорбции.| ИзобаРа адсорбции на вольфраме. [34] |
Изобары активированной адсорбции имеют всегда чрезвычайно характерную - - - образную форму. [35]
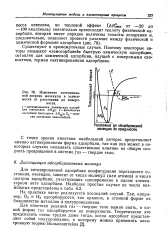 |
Изменение потенциальной энергии молекулы в зависимости от расстояния до поверхности. [36] |
Для активированной адсорбции конфигурация переходного состояния, очевидно, зависит от числа молекул ( или атомов) и числа центров адсорбции, участвующих одновременно в одном элементарном акте адсорбции. [37]
Теория активированной адсорбции не смогла стать, как это первоначально задумал Тэйлор, общей теорией адсорбционных процессов. [38]
Теплота активированной адсорбции значительно больше теплоты физической адсорбции, приближаясь по величине к теплоте обычной химической реакции. Ориентировочное значение теплоты активированной адсорбции достигает порядка нескольких сотен килоджоулей на моль поглощенного вещества. [39]
Теория активированной адсорбции сыграла в развитии катализа очень важную рольЛОна указала на возможность существования такой адсорбции, для осуществления которой необходима энергия активации. В теории активированной адсорбции развита дальше идея об участии валентных сил в процессах адсорбции и впервые четко указана возможность разрыва при этом химических связей, что открывает более широкие пути изучения сущности катализа. [40]
Теплота активированной адсорбции значительно больше теплоты физической адсорбции, приближаясь по величине к теплоте обычной химической реакции. Ориентировочное значение теплоты активированной адсорбции достигает порядка нескольких сотен килоджоулей на моль поглощенного вещества. [41]
Кинетика активированной адсорбции фосфина, представленная в билогарифмических координатах lg q / ( lg t), дает прямую линию. Из данных по кинетике активированной адсорбции, полученных при различных температурах, вычислена энергия активации процесса активированной адсорбции. [42]
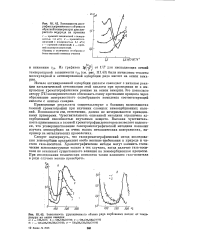 |
Зависимость логарифма удерживаемого объема от обратной температуры для хлористого водорода на кремнии.| Зависимость удерживаемого объема ряда карбоновых кислот от температуры на окиси самария. [43] |
Начало активированной адсорбции кислоты совпадает с началом реакции каталитической кетонизации этой кислоты при проведении ее в импульсном хроматографическом режиме на окиси самария. Это позволило автору [74] экспериментально обосновать схему протекания процесса через образование поверхностного солеобразного комплекса соответствующей кислоты с окисью самария. [44]
До комнатной активированная адсорбция протекает быстро, и общая величина адсорбции возрастает. [45]
Страницы: 1 2 3 4