Вандерваальсовая адсорбция
Cтраница 1
При вандерваальсовой адсорбции действуют силы того же порядка величин, что и силы взаимодействия между молекулами в жидкости. [1]
Причины неравенства отношения вандерваальсовой адсорбции этих двух типов пленок отношению поверхностей, измеренных по адсорбции при 80 К на восходящих частях изобар этих же двух типов пленок, станут ясными после рассмотрения рис. 8, на котором изображена изобара, снятая на пленке этого же типа для области от 20 до 120 К. Все точки этой изобары с повышающейся и с понижающейся температурой пронумерованы в последовательности, в которой они были определены. Так как эта изобара совершенно уплощается при 80 при величине ординаты 7 2 - 1018 на 100 мг, то из этого следует, что из общей адсорбции водорода при 20 К на долю хемосорбции приходится 7 2 - 1018 молекул на 100 мг Ni, а на долю вандерваальсовой адсорбции - 6 0 - 1018 молекул на 100 мг Ni. [2]
Точка А соответствует вандерваальсовой адсорбции ( хх1, уу1), а точка В - химической адсорбции ( х х2, У - у2) - Вершине барьера, изображенного на рис. 7, б, соответствует на рис. 7, в точка С. Очевидно, точка D может лежать как ниже, так и выше точки С. Таким образом, величина и на рис. 7, б представляет собой фиктивную величину. [3]
Объяснение, основанное на вандерваальсовой адсорбции, следует исключить из-за отсутствия корреляции между тормозящим действием и точкой кипения реагента. Особенно ярко это проявляется в случае дифенила и нафталина, обладающих резко различающейся тормозящей способностью, несмотря на близость точек кипения. [4]
Это вещество не проявило сильной вандерваальсовой адсорбции водорода, и его активность как катализатора значительно увеличилась смешением с окисью цинка, которая сама по себе является мощным адсорбентом, но слабым катализатором. [5]
До недавнего времени считали, что в случае вандерваальсовой адсорбции энергии взаимодействия между данным газом и адсорбентами разной природы не очень различны. Предполагали, что химическая природа поверхности адсорбента для физической адсорбции не существенна и величина адсорбции данного вещества на единицу поверхности любого адсорбента является одной и той же. На этих представлениях был основан широко распространенный метод БЭТ, используемый для определения удельной поверхности по низкотемпературной адсорбции азота или других адсорбатов. При этом принималось, что молекулярная площадка адсорбата остается величиной постоянной. [6]
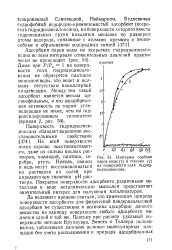 |
Изотермы сорбции паров воды ( 7 н гексаиа ( 2 на поверхности геля гидридполисилоксана. [7] |
До недавнего времени считали, что химическая природа поверхности адсорбента для физической вандерваальсовой адсорбции не существенна и величина адсорбции данного вещества на единицу поверхности любого адсорбента является одной и той же. [8]
Хемосорбция связана с теплотами адсорбции, оказывающимися большими по сравнению с теплотой вандерваальсовой адсорбции. Термин Хемосорбция подразумевает образование полухимической связи адсорбированного газа с твердой поверхностью. В таких случаях, как адсорбция водорода на металлах, скорость хемосорбции может быть неизмеримой и адсорбция может в основном протекать мгновенно. [9]
При использовании повышенного давления мы сталкиваемся с двумя трудностями: во-первых, происходит увеличение вандерваальсовой адсорбции, которая происходит даже при комнатной температуре, и, во-вторых, наблюдается увеличение адсорбции, названное нами медленным эффектом. Хорошо известно, что водород, пущенный на никель при обычной температуре, хемосорбируется почти мгновенно и что этот процесс сопровождается дальнейшей адсорбцией, протекающей в течение нескольких часов или дней. При 1 атм эта медленная адсорбция дает дополнительно 2 - 3 слг3 водорода на 1 г никеля и не приводит к какому-либо дальнейшему изменению намагничивания при обычной температуре. Однако, если давление возрастает, медленная адсорбция становится относительно быстрой, и в этих условиях объем адсорбированного водорода увеличивается. Несмотря на такого рода затруднения, можно показать, что поверхность не полностью насыщена при давлении 1 атм и добавление умеренных количеств водорода приводит к быстрой адсорбции, причем адсорбция в этом интервале следует изотерме Ленг-мюра. Едва ли было бы возможно различить эти виды адсорбции водорода без помощи магнитного метода. [10]
Таким образом, удалось, например, установить наличие как хемосорбции ( для SnO), так и вандерваальсовой адсорбции ( для 5пО2 - / гН2О) окисленного олова на поверхности силикагеля [65]; сочетание же данных об / и квадруполь-ном расщеплении позволило определить разности средних квадратов амплитуд колебаний адсорбированных атомов нормально к поверхности ( г2) и вдоль нее ( л: 2) [65] и даже абсолютные их значения. [11]
Всякого рода щели, полости, трещины, углубления в поверхности, особенно внутренние капилляры, являются более активными по отношению к вандерваальсовой адсорбции, чем гладкая поверхность. На этих активных участках теплоты адсорбции более высоки, и поэтому начальная стадия адсорбции обычно характеризуется повышенной дифференциальной теплотой адсорбции. [12]
Из сказанного ясно, что метод БЭТ дает завышенные величины монослоев в случае его применения к чистым поверхностям металлов и при пользовании газом, теплота адсорбции которого велика по сравнению с обычной теплотой вандерваальсовой адсорбции. [13]
Классические теории предлагают два взаимоисключающих объяснения: одно из них основано на предположении, что обмен каждого ароматического соединения сопровождается разного рода побочными тормозящими реакциями, а другое - на том, что концентрация реагентов на поверхности и, следовательно, скорость обмена определяются вандерваальсовой адсорбцией. [14]
Истинную величину поверхности металла нельзя измерить по методу БЭТ с азотом, так как он при - 196 хемосорбируется Адсорбция водорода при этих температурах измеряет поверхность более точно, давая хорошее совпадение с хемосорбцией окиси углерода как при температуре жидкого азота, так и при комнатной температуре, а также с вандерваальсовой адсорбцией криптона. [15]
Страницы: 1 2 3