Вандерваальсовая адсорбция
Cтраница 2
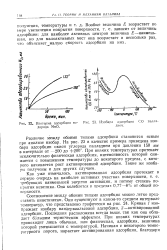 |
Изотерма адсорбции водорода МпО.| Изобара адсорбции СО палладием. [16] |
Соотношение между обоими типами адсорбции можно легко представить кинетически. Кривая 1 изображает изобару вандерваальсовой адсорбции, 2-активированной адсорбции. Последняя расположена всегда выше, так как она обладает большим термическим эффектом. При низких температурах происходит лишь обычная, или физическая, адсорбция, величина которой уменьшается с температурой. [17]
Изотерма такого вида характерна для хемосорбции на катализаторе гс-типа при наличии граничного слоя с объемным зарядом. Очевидно, этот механизм резко отличается от физической или вандерваальсовой адсорбции, описывающейся уравнением Лэнг-мюра. [18]
Как было показано на рис. 92, адсорбция додецилсульфата натрия на анионообменной смоле дауэкс 1 - Х1 превышает обменную емкость этой смолы. Эта особенность адсорбции позволяет заключить, что при более высоких равновесных концентрациях коллоидные электролиты могут адсорбироваться на смоле, образуя двойные слои, причем первый из них возникает по обменному механизму, а второй - в результате вандерваальсовой адсорбции. [19]
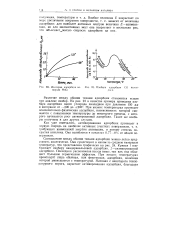 |
Изотерма адсорбции во - [ IMAGE ] Изобара адсорбции СО палла-дорода МпО. днем. [20] |
Соотношение между обоими типами адсорбции можно легко представить кинетически. Кривая / изображает изобару вандерваальсовой адсорбции, 2-активированной адсорбции. Последняя расположена всегда выше, так как она обладает большим термическим эффектом. При низких температурах происходит лишь обычная, или физическая, адсорбция, величина которой уменьшается с температурой. [21]
Между этими двумя типами адсорбции существует совершенно четкое различие. Физическая адсорбция вызывается силами молекулярного взаимодействия, к числу которых относятся [1] силы взаимодействия постоянных и индуцированных диполей, а также силы квадрупольного притяжения. Поэтому физическую адсорбцию часто называют также вандерваальсовой адсорбцией. В то же время хемосорбция связана с перераспределением электронов взаимодействующих между собой газа и твердого тела и с последующим образованием химических связей. Иными словами, физическая адсорбция подобна конденсации паров с образованием жидкости или процессу сжижения газов, а хемосорбция может рассматриваться как химическая реакция, протекание которой ограничено поверхностным слоем адсорбента. Из этих определений следует, что по мере изменения наших представлений о сущности химической связи будет соответственно меняться и представление о хемосорбции. [22]
Подобный гетерогенный катализатор адсорбирует по крайней мере один из компонентов реакционной смеси. Адсорбция может происходить под влиянием физических сил, сходных с силами, действующими при сжижении газов, или под влиянием химических сил, аналогичных силам, участвующим в образовании обычных химических соединений. Поэтому принято различать физическую адсорбцию ( называемую также вандерваальсовой адсорбцией, для того чтобы подчеркнуть физическую природу действующих сил) и химическую адсорбцию, или хемосорбцию. [23]
Адсорбция, не сопровождающаяся образованием химического соединения обычного типа, в свою очередь делится на адсорбцию физическую и адсорбцию активированную. Физическая адсорбция обусловливается силами взаимного притяжения молекул. Эти силы часто называют вандерваальсовыми, поэтому физическую адсорбцию называют также вандерваальсовой адсорбцией. Молекулярные силы притяжения могут удерживать на поверхности адсорбента несколько слоев молекул поглощенного вещества - полимолекулярная адсорбция. Следует, однако, иметь в виду, что в этом случае возможно также и образование только мономолеку ярного слоя; таким образом, наличие мономолекулярного слоя не исключает физической адсорбции. При физической адсорбции поглощенное вещество не взаимодействует с поглотителем; процесс протекает чрезвычайно быстро, и очень часто равновесие между фазами, участвующими в процессе адсорбции, устанавливается практически мгновенно. Выделяющееся при этом тепло называется теплотой адсорбции. [24]
Адсорбция, не сопровождающаяся образованием химического соединения обычного типа, в свою очередь делится на адсорбцию физическую и адсорбцию активированную. Физическая адсорбция обусловливается силами взаимного притяжения молекул. Эти силы часто называют вандерваальсовыми, поэтому физическую адсорбцию называют также вандерваальсовой адсорбцией. Молекулярные силы притяжения могут удерживать на поверхности адсорбента несколько слоев молекул поглощенного вещества - полимолекулярная адсорбция. Следует, однако, иметь в виду, что в этом случае возможно также и образование только мономолекулярного слоя; таким образом, наличие мономолекулярного слоя не исключает физической адсорбции. При физической адсорбции поглощенное вещество не взаимодействует с поглотителем; процесс протекает чрезвычайно быстро, и очень часто равновесие между фазами, участвующими в процессе адсорбции, устанавливается практически мгновенно. Выделяющееся при этом тепло называется теплотой адсорбции. [25]
Причины неравенства отношения вандерваальсовой адсорбции этих двух типов пленок отношению поверхностей, измеренных по адсорбции при 80 К на восходящих частях изобар этих же двух типов пленок, станут ясными после рассмотрения рис. 8, на котором изображена изобара, снятая на пленке этого же типа для области от 20 до 120 К. Все точки этой изобары с повышающейся и с понижающейся температурой пронумерованы в последовательности, в которой они были определены. Так как эта изобара совершенно уплощается при 80 при величине ординаты 7 2 - 1018 на 100 мг, то из этого следует, что из общей адсорбции водорода при 20 К на долю хемосорбции приходится 7 2 - 1018 молекул на 100 мг Ni, а на долю вандерваальсовой адсорбции - 6 0 - 1018 молекул на 100 мг Ni. [26]
Преимущественное концентрирование молекул на поверхности твердых и жидких тел называется адсорб-чцией. Между этими двумя типами адсорбции существует достаточно четкое различие. Физическая адсорбция вызьи-вается силами межмолекулярного взаимодействия. Поэтому ее часто называют также вандерваальсовой адсорбцией. Химическая адсорбция сопровождается образованием на поверхности твердого тела поверхностных химических соединений. Природа хемосорбционной связи идентична природе аналогичных связей в химических соединениях, однако специфика поверхности может существенно влиять на характер связи и распределение электронов во взаимодействующих атомах. [27]
Этот вывод был также получен при сопоставлении изобар для пленок металлов, испаренных в вакууме и при давлении азота 1 мм рт. ст. Найдено [1], что при давлении азота 1 мм, рт. ст. получаются ориентированные пленки, имеющие для быстрой адсорбции вдвое большую поверхность, чем поверхность неориентированных пленок такого же веса, полученных в высоком вакууме. На обоих типах пленок в небольшой степени идет и медленная сорбция. Однако позже было установлено, что в обоих этих случаях медленная сорбция одинакова, что также указывает скорее на весовой эффект, чем на связь с наличной поверхностью. Во-вторых [1], показано, что для ориентированных и не ориентированных пленок, спекавшихся при более высоких температурах, адсорбция окиси углерода при комнатной температуре уменьшалась пропорционально активности пленок обоих типов при гидрировании этилена. Опыты, подобные обсужденным в предыдущем разделе, показали, что измеренные методом БЭТ по вандерваальсовой адсорбции криптона при - 196 поверхности пленок, спекавшихся при различных температурах, также уменьшаются пропорционально уменьшению активности при гидрировании этилена при комнатной температуре. Таким образом, как относительная хемо-сорбция окиси углерода при комнатной температуре, так и ван-дерваальсова адсорбция криптона представляют надежные способы измерения поверхности, доступной для гидрирования этилена. Это же относится и к быстрой адсорбции водорода при - 196, так что она представляет третий критерий, при помощи которого можно определять каталитически активную поверхность подвергавшихся спеканию пленок. [28]
Чтобы иметь возможность определить и измерить абсорбцию по отношению ко всей сорбции и измерить теплоту адсорбции в зависимости от заполнения поверхности, а также чтобы иметь возможность решить вопрос о гетерогенности поверхности, в высшей степени важно располагать надежным методом измерения всей доступной поверхности ( Истинной поверхности), образуемой границей раздела газ-твердая фаза. Для этой цели уже более 10 лет широко используется метод Эммета-Брунауэра. Несмотря на то, что не все предпосылки, на которых Брунауэром, Эмметом и Теллером [6] основана разработка теории предложенного ими метода, кажутся приемлемыми ( например, ими не приняты во внимание силы взаимодействия между адсорбированными молекулами), нет никаких оснований смущаться этим несовершенством теории, так как она привела к методу, позволяющему при помощи одного или двух простых измерений очень быстро определить поверхность с таким же результатом, какой Эммет и Брунауэр [7] раньше выводили из формы самой изотермы. Благодаря убедительности заключений, выводимых из формы самой изотермы, можно быть совершенно уверенным в том, что любая видоизмененная и усовершенствованная теория вандерваальсовой адсорбции должна привести приблизительно к тем же величинам для монослоя, что и получаемые по методу БЭТ для истинной вандерваальсовой адсорбции. Совершенно нет необходимости доказывать, что для большинства практических целей относительные величины поверхностей гораздо важнее, чем абсолютные их величины. [29]
Чтобы иметь возможность определить и измерить абсорбцию по отношению ко всей сорбции и измерить теплоту адсорбции в зависимости от заполнения поверхности, а также чтобы иметь возможность решить вопрос о гетерогенности поверхности, в высшей степени важно располагать надежным методом измерения всей доступной поверхности ( Истинной поверхности), образуемой границей раздела газ-твердая фаза. Для этой цели уже более 10 лет широко используется метод Эммета-Брунауэра. Несмотря на то, что не все предпосылки, на которых Брунауэром, Эмметом и Теллером [6] основана разработка теории предложенного ими метода, кажутся приемлемыми ( например, ими не приняты во внимание силы взаимодействия между адсорбированными молекулами), нет никаких оснований смущаться этим несовершенством теории, так как она привела к методу, позволяющему при помощи одного или двух простых измерений очень быстро определить поверхность с таким же результатом, какой Эммет и Брунауэр [7] раньше выводили из формы самой изотермы. Благодаря убедительности заключений, выводимых из формы самой изотермы, можно быть совершенно уверенным в том, что любая видоизмененная и усовершенствованная теория вандерваальсовой адсорбции должна привести приблизительно к тем же величинам для монослоя, что и получаемые по методу БЭТ для истинной вандерваальсовой адсорбции. Совершенно нет необходимости доказывать, что для большинства практических целей относительные величины поверхностей гораздо важнее, чем абсолютные их величины. [30]
Страницы: 1 2 3