Гиббсовская адсорбция
Cтраница 3
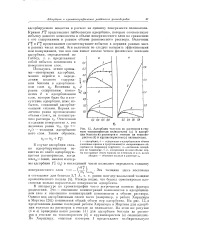 |
Адсорбция толуола из растворов в гептане тонкопористым силикагелем ( а и адсорбция бензола из растворов в гептане на тонкопористом ( б и крупнопористом ( в силикагелях. [31] |
Кривая Г ( 12 представляет гиббсовскую адсорбцию, которая соответствует избытку данного компонента в объеме поверхностного слоя по сравнению с его содержанием в равном объеме равновесного раствора. Величины Г и 1 2 представляют соответствующие избытки в порциях равных масс и равных чисел молей. [32]
В уравнении (11.41) единицы измерения величины гиббсовской адсорбции определяются единицами измерения химического потенциала. Если потенциал отнесен к молю вещества, то величина измеряется в молях на единицу площади. [33]
Таким образом, зная зависимость величины гиббсовской адсорбции от химического потенциала адсорбата, можно рассчитать интегральное изменение энергии Гиббса в системе при адсорбции. [34]
Соответствующими коэффициентами при приращениях химических потенциалов являются гиббсовские адсорбции окисленной ( Г) и восстановленной ( Г2) форм при образовании поверхности электрода без подвода электричества извне. [35]
Величины rlg и г п) аналогичны гиббсовской адсорбции Г [ 0) для случая, когда сравниваемые порции раствора, прилегающего к поверхности 1 г адсорбента, и равновесного раствора одинаковы по весу и соответственно по числу молей. [36]
В работе [97] проведено также сопоставление коэффициентов Гиббсовской адсорбции для ряда сорбатов, полученных из хроматогр афических и статических измерений. [37]
Пусть образование поверхности электрода происходит в отсутствие гиббсовской адсорбции восстановленной формы. [38]
В общем случае в электрохимических системах величины гиббсовских адсорбции ( Г) и поверхностных избытков ( А) не совпадают. [39]
При малых концентрациях компонента i в объемных фазах гиббсовская адсорбция Г / ( избыток) близка к поверхностной концентрации а; ( см. стр. [40]
При малых концентрациях компонента i в объемных фазах гиббсовская адсорбция Г ( избыток) близка к поверхностной концентрации а - ( см. стр. [41]
В равновесии адсорбированные количества В1 и Bz переходят в гиббсовские адсорбции Г и Г2 соответственно окисленной и восстановленной форм. [42]
С другой стороны, рассмотрим, чему будет равна гиббсовская адсорбция ионов водорода. Она будет зависеть от того, остаются ли ионы водорода, полученные из атомов водорода, притянутыми к поверхности, или же они вытесняются посторонними катионами в раствор. [43]
 |
Зависимость времени, необходимого для установления.| Зависимость Г от. [44] |
На рис. VI, 2 схематически показано изменение величины гиббсовской адсорбции Г в зависимости от мольной доли N адсорбтива в равновесном растворе. При сильной адсорбции адсорбтива и слабой адсорбции растворителя кривая / вначале круто поднимается вверх, проходит через максимум и затем падает до нуля почти прямолинейно. Снижение величины адсорбции Г объяс-яется тем, что при больших значениях / V концентрации адсорбтива в поверхностном слое и в объеме раствора становятся очень большими и притом одинаковыми. [45]
Страницы: 1 2 3 4